题目内容
【题目】工业上可用二氧化硫通过下列工艺过程制取氢气。
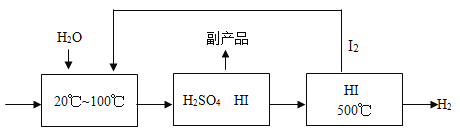
反应器 分离器膜反应器
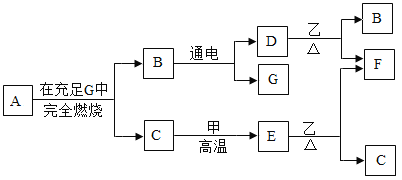
(1)H2O中,氧、氢元素的质量比为______。
(2)分离器中分离出的副产品是______,生产流程中能被循环利用的物质为______
(3)写出膜反应器中HI发生分解反应的化学反应方程式______(请注明反应条件)。
【答案】8:1 硫酸 I2 2HI![]() H2↑+I2
H2↑+I2
【解析】
(1)H2O中氧、氢元素的质量比为16:(1×2)=8:1.
(2)分离器中的物质是硫酸和碘化氢,碘化氢可用于制取氢气,则分离器中分离出的副产品是H2SO4.
既是反应物,也是生成物的物质可以循环使用,由工艺流程图可知,I2能被循环利用.
(3)膜反应器中HI气体在500℃时分解生成碘和氢气,反应的化学方程式为2HI![]() H2+I2.
H2+I2.
故答案为:(1)8:1;(2)H2SO4;I2;(3)2HI![]() H2+I2.
H2+I2.

练习册系列答案
相关题目