题目内容
某校研究性学习小组进行了一个有趣的实验探究:[提出问题]实验室有一瓶久置的NaOH,变质程度怎样?
[方案及实验]先称取13.3g 的NaOH样品(杂质为Na2CO3),配成100克溶液,然后向溶液中滴加入一定质量分数的稀盐酸100克.完全反应后溶液质量为197.8克,且其PH值为7,
[数据处理]写出以下计算过程:
(1)放出二氧化碳气体多少克?
(2)该样品中Na2CO3的质量为多少?
(3)该样品在变质前NaOH的质量为多少?
[反思与交流]根据反应方程式分析,一定质量的NaOH部分变质或全部变质,与没有变质时相比,完全反应时消耗盐酸的量______.(填不相同或相同或无法判断)
【答案】分析:【数据处理】(1)依据反应前后物质的质量之差即可得到二氧化碳的质量;
(2)依据二氧化碳的质量利用方程式即可求出碳酸钠的质量;
(3)依据钠元素在化学变化前后质量不变分析解答;
【反思与交流】依据化学反应前后元素的质量不会变化分析解答;
解答:解:【数据处理】(1)由质量守恒定律可知:完全反应后生成的二氧化碳的质量是100g+100g-197.8g=2.2g;
(2)设13.3g样品中碳酸钠的质量是x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
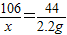 ;
;
解得:x=5.3g;
(3)样品中氢氧化钠的质量为13.3g-5.3g=8g;
设在变质生成碳酸钠5.3g的氢氧化钠质量是y
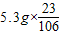 =y×
=y×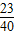
y=2g
所以变质前氢氧化钠的质量是8g+2g=10g
【反思与交流】由于变质过程中钠元素不损失也不增加,并且钠元素最终都变为氯化钠,所以可以推出消耗酸的质量相同.
故答案为:【数据处理】(1)答:完全反应后生成的二氧化碳的质量是2.2g;(2)样品中Na2CO3的质量为5.3g;(3)变质前氢氧化钠的质量是10g;
【反思与交流】相等;
点评:题难度较大,主要考查了通过数据变化找到突破口,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.
(2)依据二氧化碳的质量利用方程式即可求出碳酸钠的质量;
(3)依据钠元素在化学变化前后质量不变分析解答;
【反思与交流】依据化学反应前后元素的质量不会变化分析解答;
解答:解:【数据处理】(1)由质量守恒定律可知:完全反应后生成的二氧化碳的质量是100g+100g-197.8g=2.2g;
(2)设13.3g样品中碳酸钠的质量是x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
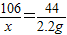 ;
;解得:x=5.3g;
(3)样品中氢氧化钠的质量为13.3g-5.3g=8g;
设在变质生成碳酸钠5.3g的氢氧化钠质量是y
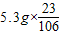 =y×
=y×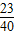
y=2g
所以变质前氢氧化钠的质量是8g+2g=10g
【反思与交流】由于变质过程中钠元素不损失也不增加,并且钠元素最终都变为氯化钠,所以可以推出消耗酸的质量相同.
故答案为:【数据处理】(1)答:完全反应后生成的二氧化碳的质量是2.2g;(2)样品中Na2CO3的质量为5.3g;(3)变质前氢氧化钠的质量是10g;
【反思与交流】相等;
点评:题难度较大,主要考查了通过数据变化找到突破口,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某校研究性学习小组的同学设计了简单的实验方案,验证呼出的气体与吸入的气体成分的含量有什么不同,请将实验现象填入下表中的空格处:
| 实验步骤 | 实验现象 |
| 1、 用排水法收集两瓶呼出的气体, 另收集两瓶空气. | 不填 |
| 2、将澄清石灰水分别滴入盛有呼出的 气体和空气的集气瓶中,振荡. | 呼出的气体中石灰水_________ |
| 3、把燃着的木条放进余下两瓶气体中 | 先熄灭的是__________________ |
| 4、对头玻璃片吹气 | 玻璃上出现______________ |
最终得出的实验结论是__________________________________.
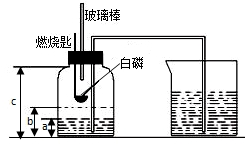 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.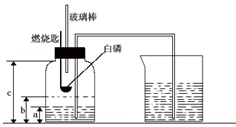 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: