题目内容
(2009?聊城)某同学在参加学校开展的综合实践活动中,考察了一家化工厂的污水处理情况.该同学考察过程中收集到以下资料:(1)该化工厂排放的污水中主要成分是盐酸,提取未经处理的污水水样l000g,加入含4gNaOH的溶液恰好完全反应(废水中其它成分不与氢氧化钠、氢氧化钙反应),该废水中氯化氢的质量分数为(本空结果精确到0.001%).
(2)该化工厂污水处理的步骤之一是:将100t污水排入中和池中进行中和处理,所用原料是较经济的氢氧化钙,请计算处理100t这种污水需要氢氧化钙的质量是多少吨?
【答案】分析:(1)可根据氢氧化钠和盐酸反应的化学方程式先求出反应的氯化氢的质量,再根据污水的质量求出氯化氢的质量分数.
(2)可以先求出100t污水中含氯化氢的质量,再写出化学方程式,根据物质的质量比,列出比例式求出氢氧化钙的质量.
解答:解:(1)设废水中氯化氢的质量为y
HCl+NaOH=NaCl+H2O
36.5 40
y 4g
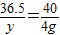
解之得:y=3.65g
∴该废水中氯化氢的质量分数= =0.365%
=0.365%
故答案为:0.365%
(2)100t废水中含氯化氢的质量为100t×0.365%=0.365t
设处理100t这种废水,需要Ca(OH)2的质量为x
2HCl+Ca(OH)2=CaCl2+2H2O
73 74
0.365t x
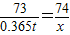
解之得:x=0.37t
答:(1)该废水中氯化氢的质量分数为0.365%;
(2)处理100t这种污水需要氢氧化钙的质量是0.37t
点评:本题主要考查学生利用化学方程式进行计算的能力,关键要掌握解题的步骤.
(2)可以先求出100t污水中含氯化氢的质量,再写出化学方程式,根据物质的质量比,列出比例式求出氢氧化钙的质量.
解答:解:(1)设废水中氯化氢的质量为y
HCl+NaOH=NaCl+H2O
36.5 40
y 4g
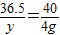
解之得:y=3.65g
∴该废水中氯化氢的质量分数=
 =0.365%
=0.365%故答案为:0.365%
(2)100t废水中含氯化氢的质量为100t×0.365%=0.365t
设处理100t这种废水,需要Ca(OH)2的质量为x
2HCl+Ca(OH)2=CaCl2+2H2O
73 74
0.365t x
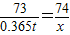
解之得:x=0.37t
答:(1)该废水中氯化氢的质量分数为0.365%;
(2)处理100t这种污水需要氢氧化钙的质量是0.37t
点评:本题主要考查学生利用化学方程式进行计算的能力,关键要掌握解题的步骤.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目