题目内容
【题目】核电荷数为1~18的元素的原子结构示意图等信息如下,回答下列问题:

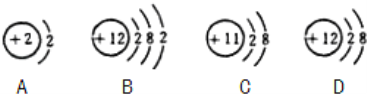
(1)在第三周期中,各原子结构的共同之处是 ;该周期中,各原子核外电子排布的变化规律是 .
(2)在第三周期中,元素类型的变化情况是:从左到右由 元素过渡到非金属元素,并以 元素结尾.
(3)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:
阳离子 ;阴离子 .
【答案】(1)原子核外都有三个电子层;最外层电子数上依次增加
(2)金属元素,稀有气体
(3)Na+/Mg2+/Al3+,O2-/F-(合理即可)
【解析】
试题分析:在元素周期表中,周期数等于原子的电子层数;在第三周期中,各原子结构的共同之处是原子核外都有三个电子层;该周期中,各原子核外电子排布的变化规律是最外层电子数上从1依次增加到8;最外层电子数小于4的原子,在反应中易失去电子,属于金属元素;最外层电子数大于4的原子,反应中易得到电子,属于非金属元素;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构;不易得失电子。属于稀有气体元素。在第三周期中,元素类型的变化情况是:从左到右由金属元素过渡到非金属元素,并以稀有气体元素结尾.同一原子中,质子数=核外电子数=核电荷数=原子序数;在阳离子中:质子数>核外电子;在阴离子中:质子数<核外电子;氖原子的核外电子排布是2、8的结构;据有相同结构的阳离子有:Na+/Mg2+/Al3+;阴离子有O2-/F-

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把100g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,也不与稀盐酸反应).请计算:
序号 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
第一次 | 25 | 14 |
第二次 | 25 | 8 |
第三次 | 25 | 2.8 |
第四次 | 25 | n |
(1)上表中n的数值为 .
(2)石灰石样品中碳酸钙的纯度是多少?
(3)求反应生成的二氧化碳的质量是多少?