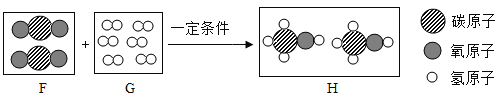
题目内容
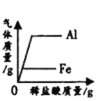
【题目】某种手机电路板中含有Fe、Cu、Ag、Ni(镍,银白色)等金属,如下是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O,镍在化合物中常显+2价。
2CuSO4+2H2O,镍在化合物中常显+2价。
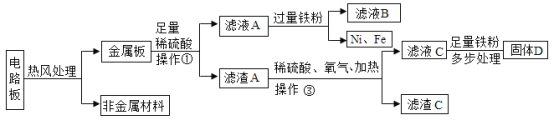
(1)操作①的名称是________;
(2)溶液A中一定含有的溶质的化学式为________;
(3)Cu、Fe、Ni在溶液中的活动性由强到弱的顺序依次是_________。
【答案】过滤 H2SO4、NiSO4、FeSO4 Fe>Ni>Cu(或Fe、Ni、Cu)
【解析】
(1)操作①能将固体与液体分离,其名称是过滤;
(2)铁与硫酸反应生成硫酸亚铁和氢气,根据流程图可知,溶液A加入过量的铁粉能生成镍,溶液A还存在硫酸镍,溶液A中一定含有的溶质的化学式为H2SO4(过量的)、NiSO4、FeSO4;
(3)铁能和硫酸镍反应生成硫酸亚铁和镍,说明铁比镍活泼,铁和镍的金属活动性顺序是铁排在镍前面,镍能与硫酸反应生在硫酸镍,说明镍的活动性是镍大于氢,铜的活动性小于氢;所以Cu、Fe、Ni在溶液中的活动性由强到弱的顺序依次是:Fe>Ni>Cu(或Fe、Ni、Cu)。

【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
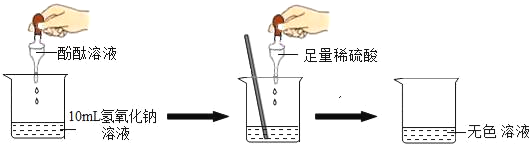
当滴入几滴酚酞试液后,溶液由无色变为_____色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为:_____。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | _____ | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | _____ | 稀硫酸过量 |
上述设计的实验方案中,正确的是_____(填“方案一”或“方案二”)。另外一个实验方案错误的原因是_____。若请你再设计一个确定稀硫酸是否过量的实验方案,你选用的药品是_____,实验现象及结论是_____。
【题目】下列各图是进行氧气、二氧化碳的实验室制取和有关性质的实验装置。
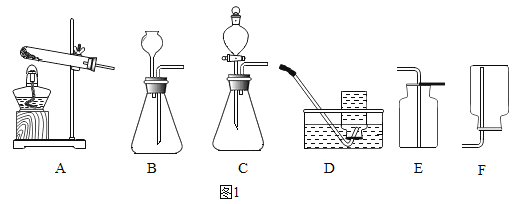
(1)图1某同学用A装置制氧气,写出该反应的化学方程式_______;若要制取一瓶二氧化碳,选用的装置为________。
(2)某化学兴趣小组的同学用图2所示的装置进行二氧化碳的性质实验(装置的气密性良好),先关闭止水夹,将足量的氢氧化钠滴入广口瓶中,充分反应后,再打开止水夹。
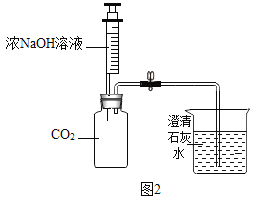
①广口瓶中观察到的现象__________。
②实验结束后,兴趣小组的同学提出新问题,广口瓶内液体的溶质可能是什么?
(猜想)
小亮:只有氢氧化钠;
小丽:氢氧化钠和氢氧化钙;
你的猜想:_______。
(探究与验证)
根据反应原理,该兴趣小组的甲、乙两位同学分别设计下列方案,对小组的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
实验操作 | 现象 | 结论 | |
甲 | 取少量广口瓶内液体,滴加几滴酚酞试液 | 溶液变红 | 小丽的猜想成立 |
乙 | 取少量广口瓶内液体,滴加_______(写一种盐溶液) | 产生白色沉淀 | 你的猜想成立 |
(反思与评价)
同学们认真研究实验流程,讨论后一致认为乙同学的方案合理。你认为甲同学设计的方案不合理的理由是
_________。