题目内容
【题目】(14分)根据下列装置图,回答有关问题:
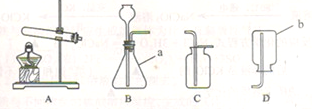
(1)写出装置图中标号仪器的名称:a____________;b____________。
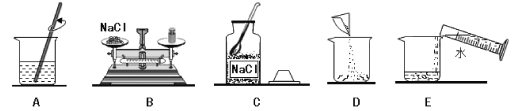
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式:__________________________。可选用的收集装置是________(填字母)。
(3)写出实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式_________________________。可选用的发生装置是________(填字母)。
(4)实验室将A装置加以改动,在高温下使碳酸钙分解生成氧化钙和二氧化碳。按此反应,试计算工业上要制取5.6t氧化钙,理论上需要含碳酸钙80%的石灰石的质量是多少?(写出计算过程)
【答案】(1)锥形瓶,集气瓶 (2)2H2O2![]() 2H2O+O2↑ ,C
2H2O+O2↑ ,C
(3)CaCO3+2HCl==CaCl2+H2O+CO2↑ ,B (4)12.5t
【解析】
试题分析:(2)根据反应物的状态和反应条件选择发生装置,用过氧化氢溶液和二氧化锰为原料制取氧气,属于固液体常温下的反应,故选B作为发生装置,氧气的密度比空气大,可用向上排空气法收集,选C装置;过氧化氢分解生成的是水和氧气:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)实验室用稀盐酸和碳酸钙制取二氧化碳,属固液在常温下的反应,选B装置;稀盐酸与碳酸钙反应生成的是氯化钙、水和二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑;
(4)碳酸钙分解生成氧化钙和二氧化碳,利用化学方程式,根据反应的质量比即可计算出需要的碳酸钙的质量。
设需要碳酸钙的质量为x,
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 56
X 5.6t
100/56 =x/5.6t
X=10t
需要含碳酸钙80%的质量=10t÷80%=12.5t
答:略