题目内容
(2013?徐汇区二模)纯碱和小苏打是厨房中两种常见用品.某兴趣小组设计了三个实验,对纯碱和小苏打两种粉末进行探究.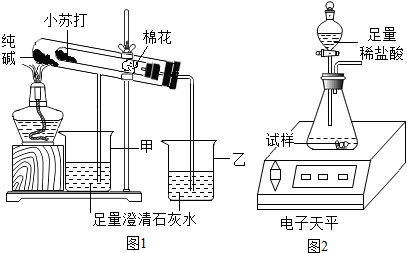
①探究两者水溶液酸碱性
你认为要比较两种溶液的酸碱性强弱,可直接用
②该兴趣小组按图1置进行实验操作,观察到乙烧杯中澄清石灰水变浑浊.
写出乙烧杯反应的化学方程式
③测定纯碱粉末的纯度.取纯碱粉末试样11.0g,利用图2置进行实验测定.数据记录如下:
(Ⅰ)反应生成CO2的物质的量为
(Ⅱ)通过计算确定纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.)
(Ⅲ) 如果测得的结果比实际纯度高,可能的原因是

①探究两者水溶液酸碱性
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别向等浓度的两种溶液中滴入酚酞试液 | 两者都变红色;纯碱溶液中颜色更深. | 纯碱和小苏打溶液都显 碱 碱 性,并可推测碳酸钠 碳酸钠 溶液碱性更强. |
pH试纸
pH试纸
进行测定.②该兴趣小组按图1置进行实验操作,观察到乙烧杯中澄清石灰水变浑浊.
写出乙烧杯反应的化学方程式
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
;该实验设计体现的思想方法是对比与观察
对比与观察
(选填:控制变量、对比与观察、定量分析、节能环保),实验目的是探究纯碱与小苏打的热稳定性
探究纯碱与小苏打的热稳定性
.③测定纯碱粉末的纯度.取纯碱粉末试样11.0g,利用图2置进行实验测定.数据记录如下:
| 称量项目 | 称量时间 | 质量/g |
| 试样+装置+稀盐酸 | 反应前 | 141.0 |
| 试样+装置+稀盐酸 | 反应开始后30s | 137.0 |
| 试样+装置+稀盐酸 | 反应开始后60s | 136.6 |
| 试样+装置+稀盐酸 | 反应开始后90s | 136.6 |
0.1mol
0.1mol
.(Ⅱ)通过计算确定纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.)
96.4%
96.4%
(Ⅲ) 如果测得的结果比实际纯度高,可能的原因是
水蒸气随CO2气体排出,从而导致所测纯度偏大
水蒸气随CO2气体排出,从而导致所测纯度偏大
.(答一种即可)分析:根据已有的知识进行分析,碳酸钠和碳酸氢钠的水溶液呈碱性,可以使用pH试纸测定其溶液的酸碱性,碳酸氢钠的热稳定性较差,根据表格提供的数据即可进行计算,据此解答即可.
解答:解:①纯碱和小苏打的水溶液都能使酚酞试液变红,说明其水溶液呈碱性,纯碱溶液中颜色更深,说明纯碱的水溶液碱性更强,要测定溶液的酸碱性强弱,可以使用pH试纸,故填:故填:碱,Na2CO3,pH试纸;
②乙烧杯中的氢氧化钙溶液会与二氧化碳反应生成碳酸钙和水,设计该实验是为了比较碳酸钠和碳酸氢钠的热稳定性,该实验需要进行对比,故填:CO2+Ca(OH)2=CaCO3↓+H2O,对比与观察,探究纯碱与小苏打的热稳定性;
③Ⅰ根据表格提供的数据可以看出,生成二氧化碳的质量为141.0g-136.6g=4.4g,其物质的量为
=0.1mol,故填:0.1mol;
Ⅱ设碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
碳酸钠的质量分数为:
×100%≈96.4%;
故填:96.4%;
Ⅲ、如果测得的结果比实际纯度高,则可能是水蒸气随二氧化碳气体排出,导致所测纯度偏大,故填:水蒸气随CO2气体排出,从而导致所测纯度偏大.
②乙烧杯中的氢氧化钙溶液会与二氧化碳反应生成碳酸钙和水,设计该实验是为了比较碳酸钠和碳酸氢钠的热稳定性,该实验需要进行对比,故填:CO2+Ca(OH)2=CaCO3↓+H2O,对比与观察,探究纯碱与小苏打的热稳定性;
③Ⅰ根据表格提供的数据可以看出,生成二氧化碳的质量为141.0g-136.6g=4.4g,其物质的量为
| 4.4g |
| 44g/mol |
Ⅱ设碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
碳酸钠的质量分数为:
| 10.6g |
| 11.0g |
故填:96.4%;
Ⅲ、如果测得的结果比实际纯度高,则可能是水蒸气随二氧化碳气体排出,导致所测纯度偏大,故填:水蒸气随CO2气体排出,从而导致所测纯度偏大.
点评:本题考查了常见物质的性质判断,完成此题,可以依据已有的知识结合题干提供的信息进行.要求同学们加强对基础知识的储备,以便灵活应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )和乙(
)和乙( )两种不同的分子,它们在一定条件下能发生化学反应,反应前后的微观变化如图所示,下列说法正确的是( )
)两种不同的分子,它们在一定条件下能发生化学反应,反应前后的微观变化如图所示,下列说法正确的是( )
 (2013?徐汇区二模)固体物质R在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示.下列说法正确的是( )
(2013?徐汇区二模)固体物质R在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示.下列说法正确的是( )