题目内容
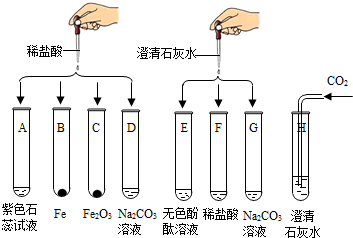
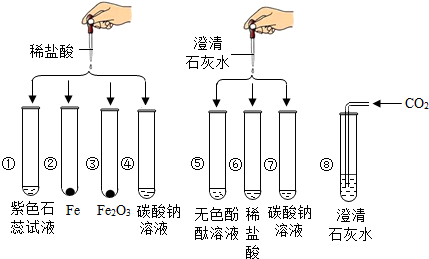
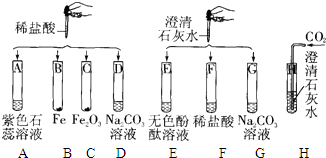 某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A~H编号后,做如下实验.
某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A~H编号后,做如下实验.(1)实验中观察到有气泡出现的试管是
B D
B D
,有沉淀生成的试管是G H
G H
.(2)写出实验中无明显现象产生的试管中发生反应的化学方程式:
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.(3)实验后某试管中为红色溶液,当向其中加入过量的
NaOH溶液
NaOH溶液
后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是紫色石蕊溶液
紫色石蕊溶液
.(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是
NaOH和Na2CO3
NaOH和Na2CO3
.(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色.为此得出溶液中一定不含有的溶质是
HCl
HCl
(填写化学式,下同),一定含有的溶质是NaCl NaOH
NaCl NaOH
.(6)通过上述实验,可归纳出盐酸的化学性质有
与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
.分析:实验中观察到有气泡出现的试管是:BD,因为B中是铁和盐酸生成氯化亚铁和氢气,D中是碳酸钠和盐酸反应生成氯化钠和水和二氧化碳;G中碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,H中二氧化碳能使澄清的石灰水变浑浊;实验中无明显现象产生的试管是F,发生的是盐酸与氢氧化钙反应生成氯化钙和水;试管A中紫色石蕊试液遇到盐酸变成红色,当向其中加入过量的NaOH溶液后,溶液变为蓝色.实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是NaOH和Na2CO3,先发生中和反应,再与碳酸钠反应有气泡冒出.第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色,说明碱过量,溶液中一定不含有盐酸,一定含有的是氯化钠和氢氧化钠;通过上述实验,可归纳出盐酸的化学性质是:盐酸与酸碱指示剂反应、盐酸与活泼金属反应、盐酸与某些金属氧化物反应、盐酸与碱反应、盐酸与某些盐反应.
解答:解:(1)实验中观察到有气泡出现的试管是:BD,因为B中是铁和盐酸生成氯化亚铁和氢气,D中是碳酸钠和盐酸反应生成氯化钠和水和二氧化碳;G中碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,H中二氧化碳能使澄清的石灰水变浑浊;故答案为:B D; G H
(2)实验中无明显现象产生的试管是F,发生的是盐酸与氢氧化钙反应生成氯化钙和水,配平即可,故答案为:Ca(OH)2+2HCl=CaCl2+2H2O
(3)试管A中紫色石蕊试液遇到盐酸变成红色,当向其中加入过量的NaOH溶液后,溶液变为蓝色,故答案为:NaOH溶液(合理答案均可);紫色石蕊溶液
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是NaOH和Na2CO3,先发生中和反应,再与碳酸钠反应有气泡冒出,故答案为:NaOH和Na2CO3
(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色,说明碱过量,溶液中一定不含有盐酸,一定含有的是氯化钠和氢氧化钠;故答案为:HCl;NaCl NaOH
(6)通过上述实验,可归纳出盐酸的化学性质是:盐酸与酸碱指示剂反应、盐酸与活泼金属反应、盐酸与某些金属氧化物反应、盐酸与碱反应、盐酸与某些盐反应,故答案为:与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
(2)实验中无明显现象产生的试管是F,发生的是盐酸与氢氧化钙反应生成氯化钙和水,配平即可,故答案为:Ca(OH)2+2HCl=CaCl2+2H2O
(3)试管A中紫色石蕊试液遇到盐酸变成红色,当向其中加入过量的NaOH溶液后,溶液变为蓝色,故答案为:NaOH溶液(合理答案均可);紫色石蕊溶液
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是NaOH和Na2CO3,先发生中和反应,再与碳酸钠反应有气泡冒出,故答案为:NaOH和Na2CO3
(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色,说明碱过量,溶液中一定不含有盐酸,一定含有的是氯化钠和氢氧化钠;故答案为:HCl;NaCl NaOH
(6)通过上述实验,可归纳出盐酸的化学性质是:盐酸与酸碱指示剂反应、盐酸与活泼金属反应、盐酸与某些金属氧化物反应、盐酸与碱反应、盐酸与某些盐反应,故答案为:与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
点评:本考点探究了酸和碱的性质,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
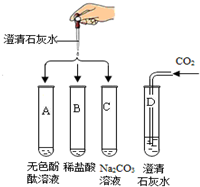 某化学实验小组欲探究氢氧化钙的化学性质,取4支试管分别用A-D编号后,做如下实验.
某化学实验小组欲探究氢氧化钙的化学性质,取4支试管分别用A-D编号后,做如下实验.