题目内容
已知30℃时硝酸钾的溶解度为45.8g。在这温度时,某硝酸钾溶液500g中溶有硝酸钾137.4g。如果蒸发掉90g水后,再冷却到30℃,可析出多少克硝酸钾?
分析:首先要通过计算得知这硝酸钾溶液是不是饱和溶液?根据硝酸钾在30℃时的溶解度和关系式得:

![]()
![]()
由于137.4g<157.1g,可知原溶液是不饱和溶液。
蒸发水时,溶液首先应由不饱和变成饱和,在这过程蒸发掉的水,并不能引起硝酸钾结晶析出。当溶液达到饱和后,继续蒸发掉的水才能使硝酸钾晶体析出。
如果蒸发掉90g水后,溶液仍不饱和,则不会有硝酸钾晶体析出。
解答:设30℃时137.4g硝酸钾配成饱和溶液时需水x克。
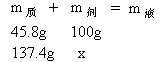
![]()
![]()
原溶液里所含的水为:
500g-137.4g=362.6g
使溶液由不饱和变为饱和,在这过程所蒸发掉的水为:
362.6g-300g=62.6g
溶液达到饱和后,继续蒸发的水为:
90g-62.6g=27.4g
30℃时,溶解在27.4g水里的硝酸钾会全部结晶析出。

![]()
答:能析出硝酸钾晶体12.55g。

练习册系列答案
相关题目
已知20℃时硝酸钾的溶解度为31.6g,在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为( )
| A、24.0% | B、28.6% | C、31.6% | D、40.0% |