题目内容
镁在空气中燃烧生成氧化镁和氮化镁(其中氮为-3价),氮化镁与水反应生成氢氧化镁和氨气.(1)写出氮化镁与水反应的化学方程式 ;
(2)若有24g镁在空气中完全燃烧,则所得产物的总质量与40g的关系是 .
(3)已知氮化镁是一种黄绿色的固体.根据镁在空气中燃烧的实验现象,可知在这样的条件下,镁更易与空气中的 化合,理由是 .
(4)镁条还能在二氧化碳中燃烧,生成一种白色固体和一种黑色固体,请写出该反应的 该化学反应的基本类型 .
【答案】分析:(1)根据氮化镁和水会生成氧化镁和氨气进行分析;
(2)根据质量守恒定律进行分析;
(3)根据镁在空气中燃烧的实验现象,以及空气的成分进行分析;
(4)根据质量守恒定律分析反应物、生成物以及反应条件书写方程式.
解答:解:(1)氮化镁和水反应生成氢氧化镁沉淀和氨气,故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
(2)设24g镁与氧气完全反应生成氧化镁的质量为x,24g镁与氮气完全反应生成氮化镁的质量为y,
2Mg+O2 2MgO
2MgO
48 80
24 x
 =
=
x=40g,
3Mg+O2 Mg3N2
Mg3N2
72 100
24 y
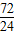 =
=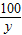
y=33.3g,
故所得产物的总质量<40g,故答案为:<;
(3)镁在空气中燃烧产生白烟,判断产物是白色固体,是氧化镁,氮化镁是一种黄绿色的固体,故在这样的条件下,镁更易与空气中的氧气化合,故答案为:O2;
(4)镁和二氧化碳在点燃的条件下生成氧化镁和碳,该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应,
故答案为:2Mg+CO2 2MgO+C,置换反应.
2MgO+C,置换反应.
点评:解此类题首先要会根据反应物,生成物,反应条件正确书写方程式,其次要会根据方程式各物质之间的质量比求出对应物质的质量,这样就可以正确求解了.
(2)根据质量守恒定律进行分析;
(3)根据镁在空气中燃烧的实验现象,以及空气的成分进行分析;
(4)根据质量守恒定律分析反应物、生成物以及反应条件书写方程式.
解答:解:(1)氮化镁和水反应生成氢氧化镁沉淀和氨气,故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
(2)设24g镁与氧气完全反应生成氧化镁的质量为x,24g镁与氮气完全反应生成氮化镁的质量为y,
2Mg+O2
 2MgO
2MgO48 80
24 x
 =
=
x=40g,
3Mg+O2
 Mg3N2
Mg3N272 100
24 y
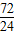 =
=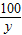
y=33.3g,
故所得产物的总质量<40g,故答案为:<;
(3)镁在空气中燃烧产生白烟,判断产物是白色固体,是氧化镁,氮化镁是一种黄绿色的固体,故在这样的条件下,镁更易与空气中的氧气化合,故答案为:O2;
(4)镁和二氧化碳在点燃的条件下生成氧化镁和碳,该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应,
故答案为:2Mg+CO2
 2MgO+C,置换反应.
2MgO+C,置换反应.点评:解此类题首先要会根据反应物,生成物,反应条件正确书写方程式,其次要会根据方程式各物质之间的质量比求出对应物质的质量,这样就可以正确求解了.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
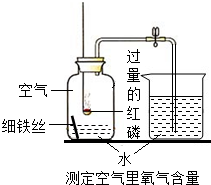 学习了空气中氧气的含量测定后,化学兴趣小组的同学对过量的红磷能否消耗完瓶中的氧气表示有疑问.请你参与他们的探究活动,并回答下列的问题:
学习了空气中氧气的含量测定后,化学兴趣小组的同学对过量的红磷能否消耗完瓶中的氧气表示有疑问.请你参与他们的探究活动,并回答下列的问题:

 15、镁在空气中燃烧,生成氧化镁,其固体质量变化如右图所示,则 固(80-48)g表示的质量是
15、镁在空气中燃烧,生成氧化镁,其固体质量变化如右图所示,则 固(80-48)g表示的质量是