题目内容
下列图像能正确反映其对应变化关系的是
|
|
|
|
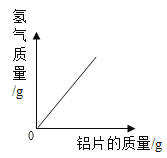
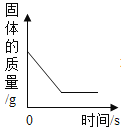
A足量镁条在密闭容器中燃烧 | B向一定质量的稀盐酸中加入足量的铝片 | C将铁钉加入足量的硫酸铜溶液中 | D一定条件下氧化铜和碳粉恰好完全反应 |
A.A B.B C.C D.D
 名校课堂系列答案
名校课堂系列答案碳酸氢铵是一种常用的化肥,小组同学对碳酸氢铵进行相关的探究:
[查阅资料] (1)碳酸氢铵是一种白色粒状晶体,有氨味,易溶于水。
(2)氨气具有刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
[提出问题]碳酸氢铵有哪些化学性质?
[作出猜想]猜想一:碳酸氢铵能与酸反应;
猜想二:碳酸氢铵能与碱反应;
猜想三:碳酸氢铵易分解。
[设计与实验]
实验操作 | 实验现象 | 实验结论 | |
1 | ______ | 有气泡产生 | 猜想一正确 |
2 | 取少量碳酸氢铵样 品与熟石灰混合研磨 | ____ | 猜想二正确 |
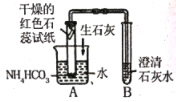
3 |
| 红色石蕊试纸变蓝,澄清石灰水变浑浊 | 猜想三正确,B中发生反应的化学方程式 为____ |
[反思] (1)实验3中向水中加入氧化钙的目的是_______。
(2)有同学对实验2的结论提出质疑:碳酸氢铵易分解产生有刺激性气味的气体,研磨会使温度升高,能加快碳酸氢铵分解,所以实验2的结论不严谨。
[补充探究]有同学为了进一步验证猜想二,进行如下实验:
实验操作 | 实验现象 |
①将碳酸氢铵溶液加入到氢氧化钙溶液中 | 有白色沉淀生成,但没有气体逸出 |
②将碳酸氢铵溶液加入到氢氧化钠溶液中 | 有刺激性气味的气体生成 |
[分析]根据常见酸、碱、盐的溶解性分析,①实验中生成的白色沉淀是____,实验中没有气体逸出可能的原因是_______。
[实验结论]三个猜想均正确。
[拓展应用]保存或使用碳酸氢铵时,需注意_______(写出一点)。
材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁。
(一)单质铁钉的一系列变化。

(1)变化①的原因是铁与空气中的水、______等物质发生一系列复杂反应的结果。
(2)变化②的实验现象是:铁锈消失,______,发生反应的化学方程式为______
(二)铁及其化合物的实验
硫酸亚铁铵(俗称摩尔盐)化学式为FeSO4· (NH4)2SO4· 6H2O,是一种重要的化工原料, 用途十分广泛。
Ⅰ 硫酸亚铁铵晶体制备。 资料:溶质从溶液里结晶析出时,晶体里结合着一定数目的水分子,这样的水分子叫结晶水。 硫酸亚铁铵晶体易溶于水,不溶于乙醇。
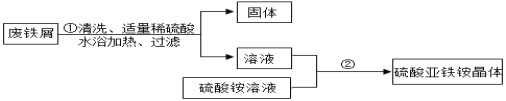
(1)在步骤①前要对废铁屑进行预处理,先利用洗涤剂的______作用除去油污。
(2)操作②中发生了一系列变化,目的是得到硫酸亚铁铵晶体。其中的操作顺序是: b→______→______→d;
a 过滤b 加热浓缩c 降温结晶d 洗涤干燥
(3)操作②中使用乙醇洗涤。这样做的优点是______;
A 避免用水洗涤所造成的晶体损耗B 酒精易挥发,可低温晾干晶体
Ⅱ 硫酸亚铁铵晶体热分解实验
兴趣小组称取此晶体样品 39.2g,在科研人员的指导下用如图装置进行热分解实验。
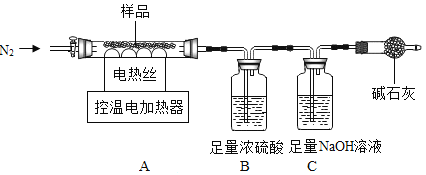
(查阅资料)①硫酸亚铁铵晶体在 200℃完全失去结晶水,剩余物在 500℃完全分解为铁的某氧化物、SO2、SO3、NH3 和 H2O。
②B 装置中浓硫酸只能吸收 NH3、SO3 和 H2O。
(1)装配好实验装置后,先要______。
(2)控制不同的温度对 A 中固体加热,测得装置 B 和 C 中的质量变化如表。
A装置中温度/℃ | 室温 | 100 | 500 |
B装置/g | 200.00 | X | 228.00 |
C装置/g | 100.00 | 100.00 | 103.20 |
①表格中 X=______。
②请你根据表中实验数据,计算出最终生成的 SO3 质量______?(写出计算过程)
(3)加热前后及过程中均需通入 N2,停止加热后继续通 N2 的目的是防止液体倒吸和______



 取用固体
取用固体 加热液体
加热液体 测溶液的pH
测溶液的pH 蒸发溶液
蒸发溶液