题目内容
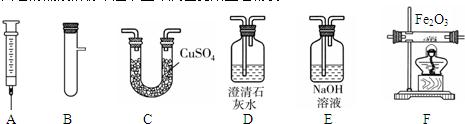
(6分)某同学用下图所示装置制取纯净、干燥的CO,并测定某氧化铜和铜的混合物中铜单质的含量。
资料
①常温下,甲酸(HCOOH)是无色易挥发的液体,在浓硫酸作用下易分解。
甲酸分解的化学方程式为:HCOOH CO↑+ H2O。
CO↑+ H2O。
②浓硫酸具有吸水性,难挥发,常用作干燥剂。

(1)E中澄清石灰水变浑浊,反应的化学方程式是 。
(2)装置B的作用是 ,装置C中的试剂是 。点燃装置F中酒精灯的目的是
。
(3)实验结束时,熄灭酒精灯的顺序是 (填对应装置序号)。
(4)若称取该混合物5.0 g,充分反应后,玻璃管中剩余固体的质量为4.8 g。原混合物中铜单质的质量分数为 。
(1)CO2 + Ca(OH) 2 = CaCO3↓+ H2O
(2)除去挥发出来的甲酸 浓硫酸 处理尾气,防止空气污染
(3)DAF (4)80%
【解析】
试题分析:(1)E中澄清石灰水变浑浊,是二氧化碳与氢氧化钙反应了,反应的化学方程式是CO2 + Ca(OH) 2 = CaCO3↓+ H2O;
(2)装置B的作用是除去挥发出来的甲酸,装置C中的试剂是浓硫酸,干燥气体。点燃装置F中酒精灯的目的是处理尾气,防止空气污染;
(3)实验结束时,熄灭酒精灯的顺序是DAF,即待氧化铜的反应停止后,先停止其加热,,此时继续通入一氧化碳,待其冷却后,再停止通入一氧化碳,但因一氧化碳有毒,故最后熄灭F酒精灯,用来除去一氧化碳,防止污染环境。
(4)若称取该混合物5.0 g,充分反应后,玻璃管中剩余固体的质量为4.8 g。即有5.0-4.8=0.2g氧元素消失,设原混合物中铜单质的质量分数为x%,则有5.0×(1- x%)×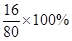 =0.2g,
=0.2g,
x%=80%。
考点:二氧化碳的性质;化学方程式;一氧化碳的性质;实验设计与探究;化合物中元素的质量分数。
点评:二氧化碳能使澄清石灰水变浑浊;一氧化碳有毒;
某元素的质量分数=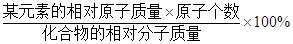 。
。

 走进文言文系列答案
走进文言文系列答案