题目内容
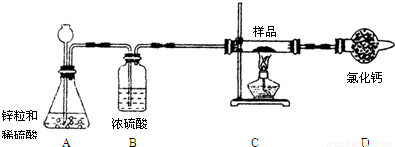
小明在研究性学习中了解到氢气具有还原性.他设计了一个实验,利用氢气的还原性来探究某不纯的氧化铜样品中氧化铜的质量分数(杂质为铜,不与氢气反应),C装置中发生反应的化学方程式为:CuO+H2
Cu+H2O
(提示:氯化钙固体可用作干燥剂,装置图如下图所示,部分起固定作用的装置未画出.)
为测定该氧化铜样品中氧化铜的质量分数,请回答问题.
(1)第一小组设计如下实验方案:称取10g样品,放在上图所示装置的玻璃管中,使其充分反应,测得D装置质量增加了1.8g,则该样品中氧化铜的质量分数为
(2)在第一小组设计的方案中,如果将B装置删去,对测定的结果(填“有”或“无”)
(3)第二小组设计的方案:称取10g样品,放入足量的稀硫酸中,欲计算该样品中氧化铜的质量分数,还需测定的一种数据是
| ||
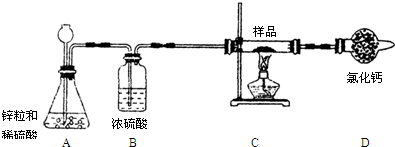
(提示:氯化钙固体可用作干燥剂,装置图如下图所示,部分起固定作用的装置未画出.)
为测定该氧化铜样品中氧化铜的质量分数,请回答问题.

(1)第一小组设计如下实验方案:称取10g样品,放在上图所示装置的玻璃管中,使其充分反应,测得D装置质量增加了1.8g,则该样品中氧化铜的质量分数为
80%
80%
.(2)在第一小组设计的方案中,如果将B装置删去,对测定的结果(填“有”或“无”)
有
有
影响.(3)第二小组设计的方案:称取10g样品,放入足量的稀硫酸中,欲计算该样品中氧化铜的质量分数,还需测定的一种数据是
充分反应后剩余固体的质量
充分反应后剩余固体的质量
.分析:(1)D装置质量增加了1.8g为水的质量,根据水的质量求出氧化铜的质量从而该样品中氧化铜的质量分数;
(2)根据浓硫酸的作用进行解答;
(3)根据铜不和稀硫酸反应进行解答.
(2)根据浓硫酸的作用进行解答;
(3)根据铜不和稀硫酸反应进行解答.
解答:解:(1)D装置质量增加了1.8g为水的质量,设参见反应氧化铜的质量为x.
CuO+H2
Cu+H2O
80 18
x 1.8g
=
x=8.0g
该样品中氧化铜的质量分数=
×100%=80%
答:该样品中氧化铜的质量分数80%.
(2)浓硫酸具有吸水性,可以干燥氢气,如果将B装置删去,可能导致D装置质量增加的多,从而影响测定的结果;
(3)铜不和稀硫酸反应,称取10g样品,放入足量的稀硫酸中,充分反应后剩余固体的质量为铜的质量,从而求出氧化铜的质量.
故答案为:(1)80%;
(2)有;
(3)充分反应后剩余固体的质量.
CuO+H2
| ||
80 18
x 1.8g
| 80 |
| x |
| 18 |
| 1.8g |
x=8.0g
该样品中氧化铜的质量分数=
| 8.0g |
| 10g |
答:该样品中氧化铜的质量分数80%.
(2)浓硫酸具有吸水性,可以干燥氢气,如果将B装置删去,可能导致D装置质量增加的多,从而影响测定的结果;
(3)铜不和稀硫酸反应,称取10g样品,放入足量的稀硫酸中,充分反应后剩余固体的质量为铜的质量,从而求出氧化铜的质量.
故答案为:(1)80%;
(2)有;
(3)充分反应后剩余固体的质量.
点评:本题主要考查氢气还原氧化铜、以及根据水的质量求出氧化铜的质量等方面的知识,书写化学方程式时要注意遵循质量守恒定律.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
小光在研究性学习中了解到氢气具有还原性。他设计了一个实验,利用氢气的还原性来探究某不纯的氧化铜样品中氧化铜的质量分数(杂质为铜,不与氢气反应),C装置中发生反应的化学方程式为:H2+CuO![]() Cu+H2O
Cu+H2O
友情提示:氯化钙固体可用作干燥剂。装置图如下所示,部分起固定作用的装置未画出。
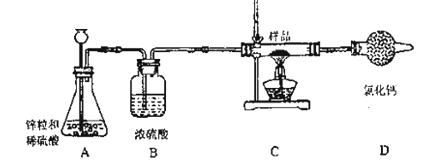
|
(2)小明同学用同样的装置进行实验,实验结果与小光所得的正确结果比较出现偏差,请分析可能造成误差的原因(写一条即可):
(3)小光是利用氢气还原氧化铜的原理进行测定,请你简要写出其它测定样品中氧化铜的质量分数的方法和要测定的数据(用文字叙述,无需写出具体质量数值)。
 Cu+H2O
Cu+H2O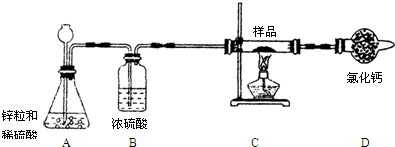
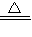 Cu+H2O
Cu+H2O