题目内容
【题目】下图是实验室制取氧气或二氧化碳时经常用到的装置,请回答有关问题。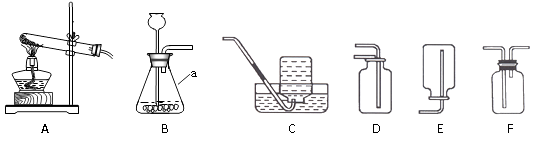
(1)写出仪器a的名称:;
(2)实验室用氯酸钾制取干燥的氧气时,可选用的收集装置是(填编号);
(3)装置B可以用来制取氢气,实验室用锌和稀硫酸制取氢气的反应化学方程式是 , 该反应属于(填化学反应基本类型);
(4)实验室制取二氧化碳气体时,为了控制反应的发生和停止,可选用下图中的装置(填编号),选用该发生装置制取气体需满足的一般条件是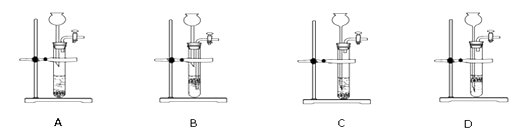
(5)实验室制取二氧化碳时,所用大理石与100g稀盐酸恰好完全反应(杂质不参与反应),生成8.8g二氧化碳,求大理石中所含碳酸钙的物质的量为多少?(根据化学方程式列式计算)
【答案】
(1)锥形瓶
(2)D、F
(3)Zn+H2SO4→ZnSO4+H2↑,置换反应
(4)D,块状固体和液体反应,反应不需要加热
(5)解:n(CO2)=8.8/44=0.2(mol)
设大理石中含碳酸钙的物质的量为x
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
1 | 1 | ||
x | 0.2mol |
列比例式得: ![]()
解得:x=0.2mol
答:大理石中所含碳酸钙的物质的量为0.2mol。
【解析】(1)根据常见仪器名称可知仪器A的名称为锥形瓶;
(2)实验室收集干燥的氧气不能用排水法只能用排空气法,由于氧气的密度比空气的大,所以采用向上排空气法收集;
(3)锌和稀硫酸制取氢气的化学反应方程式为Zn+H2SO4→ZnSO4+H2↑;该反应属于置换反应;
(4)仪器D的工作原理类似启普发生器,把块状大理石放置在有空塑料板上,长颈漏斗底端应插入到有空塑料板位置以下,从长颈漏斗口加入稀盐酸,当盐酸浸没大理石反应开始,当夹紧橡胶管时,试管中充满二氧化碳气体,压强变大,把稀盐酸压入到长颈漏斗中,稀盐酸与块状大理石分开,反应停止,故选D,选用该发生装置制取气体需满足的一般条件是块状固体和液体反应,反应不需要加热;
⑤该反应中大理石中的碳酸钙反应完全,
解:n(CO2)=8.8/44=0.2(mol)
设大理石中含碳酸钙的物质的量为x
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
1 | 1 | ||
x | 0.2mol |
列比例式得: ![]()
解得:X=0.2mol
答:大理石中所含碳酸钙的物质的量为0.2mol.
【考点精析】通过灵活运用氢气的制取和检验和书写化学方程式、文字表达式、电离方程式,掌握氢气的实验室制法原理:Zn + H2SO4 = ZnSO4 +H2↑;Zn + 2HCl = ZnCl2 +H2↑不可用浓盐酸的原因 浓盐酸有强挥发性 ;不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性;注意:a、配平 b、条件 c、箭号即可以解答此题.

【题目】下列现象及变化用原子、分子的知识解释正确的是
A. 很远闻到花香——分子在不断运动 B. 水结成冰——分子停止运动
C. 温度计汞柱上升——原子的体积变大 D. 双氧水制氧气——原子种类发生了改变
【题目】在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 30 | 55 | 20 | 70 |
反应后的质量/g | 0 | 100 | x | 5 |
根据质量守恒定律判断,x 的值为
A. 50 B. 40 C. 70 D. 15