题目内容
(2011?东城区一模)生活中离不开水.若水的硬度过大,会影响人体健康,因此需要进行软化处理.(1)小文利用阳离子交换树脂对某硬水水样进行软化,其
原理示意如右图所示.树脂的作用是除去硬水中的______.
(2)生活中通过煮沸能够降低水的硬度.小文取此水样煮
沸后,发现有水垢生成.为探究水垢的成分,他进行了以下实验:
实验过程:
| 实验序号 | 实验操作 | 实验现象 |
| Ⅰ |  | 水垢变白、变疏松, 澄清石灰水变浑浊 |
| Ⅱ |  | 固体部分溶解, 放出热量, 滤液的pH约为12 |
| Ⅲ | 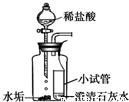 | 实验现象是______. |
①由实验Ⅰ可知,水垢分解的产物中一定有______.
②实验Ⅲ小试管内发生反应的化学方程式为______.
③根据实验探究,推测此水垢的成分中可能含有______.
(3)小文另取该水样,加入澄清石灰水,溶液变浑浊,其反应为:
A+Ca(OH)2═2CaCO3↓+2H2O,则A的化学式为______.

【答案】分析:生活中离不开水,若水的硬度过大,会影响人体健康,因此需要进行软化处理;硬水处理的目的就是除去硬水中的钙、镁离子,主要是钙离子.
解答:解:
(1)利用阳离子交换树脂对某硬水进行软化,就是通过阴阳离子交换除去硬水中的钙离子,因此树脂的作用就是除去硬水中的钙离子;
(2)水垢的成分是碳酸钙,实验III实际上就是盐酸和碳酸钙的反应,同时用澄清的石灰水验证产物是二氧化碳,因此其现象为:水垢溶解,产生气泡,澄清石灰水变浑浊;
实验分析及结论:
①实验Ⅰ的现象是水垢变白、变疏松,澄清石灰水变浑浊可知,水垢分解的产物中一定有二氧化碳;
②实验Ⅲ小试管内发生反应是二氧化碳和澄清石灰水的反应,因此其化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
③根据以上实验推测,此水垢的成分中可能含有碳酸钙;
(3)小文另取该水样,加入澄清石灰水,溶液变浑浊,说明水样中含有碳酸氢根离子,其反应为:
Ca(HCO3)2+Ca(OH)2═2CaCO3↓+2H2O;
故答案为:
(1)Ca2+;
(2)实验III现象是:水垢溶解,产生气泡,澄清石灰水变浑浊;
实验分析及结论:
①二氧化碳; ②Ca(OH)2+CO2═CaCO3↓+H2O; ③碳酸钙;
(3)Ca(HCO3)2.
点评:此题主要考查了硬水的软化,它是化工生产和生活中经常用到的,理解了硬水软化原理和二氧化碳的性质做该题并不难.
解答:解:
(1)利用阳离子交换树脂对某硬水进行软化,就是通过阴阳离子交换除去硬水中的钙离子,因此树脂的作用就是除去硬水中的钙离子;
(2)水垢的成分是碳酸钙,实验III实际上就是盐酸和碳酸钙的反应,同时用澄清的石灰水验证产物是二氧化碳,因此其现象为:水垢溶解,产生气泡,澄清石灰水变浑浊;
实验分析及结论:
①实验Ⅰ的现象是水垢变白、变疏松,澄清石灰水变浑浊可知,水垢分解的产物中一定有二氧化碳;
②实验Ⅲ小试管内发生反应是二氧化碳和澄清石灰水的反应,因此其化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
③根据以上实验推测,此水垢的成分中可能含有碳酸钙;
(3)小文另取该水样,加入澄清石灰水,溶液变浑浊,说明水样中含有碳酸氢根离子,其反应为:
Ca(HCO3)2+Ca(OH)2═2CaCO3↓+2H2O;
故答案为:
(1)Ca2+;
(2)实验III现象是:水垢溶解,产生气泡,澄清石灰水变浑浊;
实验分析及结论:
①二氧化碳; ②Ca(OH)2+CO2═CaCO3↓+H2O; ③碳酸钙;
(3)Ca(HCO3)2.
点评:此题主要考查了硬水的软化,它是化工生产和生活中经常用到的,理解了硬水软化原理和二氧化碳的性质做该题并不难.

练习册系列答案
相关题目

