题目内容
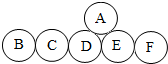 (2012?江宁区二模)A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、一氧化碳、二氧化碳中的一种.他们之间有如图所示的反应关系,图中相连的两圆表示相应物质间能发生反应. 回答下列问题:
(2012?江宁区二模)A、B、C、D、E、F分别是氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液、氢氧化钠溶液、一氧化碳、二氧化碳中的一种.他们之间有如图所示的反应关系,图中相连的两圆表示相应物质间能发生反应. 回答下列问题:(1)C物质在日常生活中的一项重要应用是
灭火
灭火
.(2)E与F反应的实验现象是
固体逐渐减少,溶液由无色变为黄色
固体逐渐减少,溶液由无色变为黄色
.(3)A与D反应的化学方程式为
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.(4)B能转化成A,反应的化学方程式为
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.分析:根据物质的性质进行分析,氧化铁能与盐酸和一氧化碳反应,盐酸能与氧化铁、氢氧化钙、氢氧化钠以及碳酸钠反应,氢氧化钙能与盐酸、碳酸钠以及二氧化碳反应,氢氧化钠能与盐酸以及二氧化碳反应,一氧化碳只能与氧化铁反应,二氧化碳能与氢氧化钠以及氢氧化钙反应,据此进行解答即可.
解答:解:根据物质间的反应可知,盐酸能发生四个反应,氢氧化钙能发生三个反应,故D和E为盐酸或氢氧化钙,A既能与D反应又能与E反应,则A是碳酸钠,C、B、F为二氧化碳、氧化铁或一氧化碳,而C能与D和B反应,若D是氢氧化钙,则C是二氧化碳,B为氢氧化钠,E为盐酸,F为氧化铁,代入框图,推断合理;
(1)C是二氧化碳,既不燃烧也不支持燃烧,能用于灭火,故填:灭火;
(2)E是盐酸,F是氧化铁,氧化铁能与盐酸反应生成易溶于水的氯化铁,氯化铁的水溶液为黄色,可以看到固体逐渐减少,溶液由无色变为黄色,故填:固体逐渐减少,溶液由无色变为黄色;
(3)A是碳酸钠,D是氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)B为氢氧化钠,能与二氧化碳反应生成碳酸钠和水,故填:2NaOH+CO2=Na2CO3+H2O.
(1)C是二氧化碳,既不燃烧也不支持燃烧,能用于灭火,故填:灭火;
(2)E是盐酸,F是氧化铁,氧化铁能与盐酸反应生成易溶于水的氯化铁,氯化铁的水溶液为黄色,可以看到固体逐渐减少,溶液由无色变为黄色,故填:固体逐渐减少,溶液由无色变为黄色;
(3)A是碳酸钠,D是氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(4)B为氢氧化钠,能与二氧化碳反应生成碳酸钠和水,故填:2NaOH+CO2=Na2CO3+H2O.
点评:本题为框图式物质推断题,完成此题,可以依据题干提供的信息,结合物质的性质进行.要求同学们熟练掌握常见物质的性质,以便灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
