题目内容
【题目】若用下图提供的装置,用CO还原Fe2O3,并回答问题。
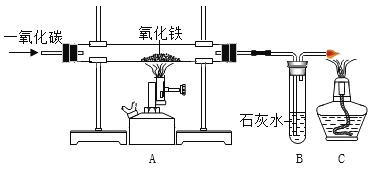
(1)实验开始时先通一氧化碳,再加热氧化铁的目的是_______________________。
(2)A中发生反应的实验现象是_________________________; 装置B中足量澄清石灰水的作用:①_________________________,②____________________________。
(3)C处酒精灯的燃料酒精燃烧的化学方程式_______________________________。
(4)某炼铁厂,日产含铁96 %的生铁100t,问该厂每天至少需要含氧化铁80%的赤铁矿石多少吨?(写出计算过程,计算结果保留一位小数)______________________
【答案】 排尽装置中的空气,防止加热时发生爆炸。或防止一氧化碳不纯,使双通管爆炸 红棕色粉末变成黑色 检验二氧化碳 吸收二氧化碳气体 方程式:略 设:需要含氧化铁80%的赤铁矿石的质量为x
3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
160 112
80% x 100t×96 %
160/80%x=112/100t×96%
x=171.4 t(1分)
【解析】(1) 实验开始时先通一氧化碳,再加热氧化铁的目的是排尽装置中的空气,防止加热时发生爆炸。或防止一氧化碳不纯,使双通管爆炸。(2) A中发生反应的实验现象是红棕色粉末变成黑色。装置B中足量澄清石灰水的作用:①检验二氧化碳,②吸收二氧化碳气体。(3)C处酒精灯的燃料酒精燃烧的化学方程式是C2H5OH+3O2 ![]() 2CO2+3H2O .
2CO2+3H2O .
(4)解∶设需要含氧化铁80%的赤铁矿石的质量为xt。
3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
160 112
80% x 100t×96 %
160 / 80% x = 112 / 100t×96 % x=171.4 t(1分)
答:需要含氧化铁80%的赤铁矿石的质量为171.4吨。
点睛∶本题主要考查与CO还原Fe2O3 实验相关的知识以及根据化学方程式进行计算。

【题目】某化学兴趣小组利用如图所示装置探究燃烧条件。

【查阅资料】红磷的着火点为260℃,烟煤的着火点为550℃
【提出猜想】
猜想1:______________________________________________;猜想2:物质需要与氧气接触
猜想3:_____________________________________________;
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
①连接装置,打开弹簧夹,___________; | ___________________________ | 装置气密性良好 |
②装药品 | ||
③点燃酒精灯,对准石灰石部位加热 | 右侧红磷燃烧,石灰石不燃烧 | 猜想1成立 |
④待右边红磷(足量)熄灭后,______________; | ___________________________ | 猜想2成立 |
⑤_________________________________ | 左侧红磷燃烧,烟煤不燃烧 | 猜想3成立 |
【反思交流】
(1)实验过程中右侧注射器的作用是_____________________________________________;
(2)有同学认为本实验中石灰石是多余的,理由是________________________________________。
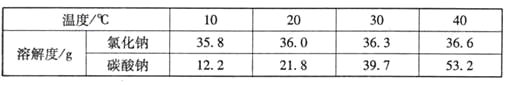
【题目】根据下表回答相关问题。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①表中两种物质的溶解度相等的温度范围是在___________℃。
②20℃时,硝酸钾的溶解度是31.6 g/100g水,其含义是___________。该温度下,将20gKNO3
放入50g水中,充分搅拌,所得溶液的质量是_______g。要进一步提高该溶液的溶质质量分数,可进行的操作是__________。
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是_________ 。
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:

上述溶液中所含溶质的质量D_____E(填“>”或“<”或“=”,下同),溶液不饱和的是___(用A、B、C、D、E填空),溶液B、C、E中溶质质量分数的大小关系是__________。