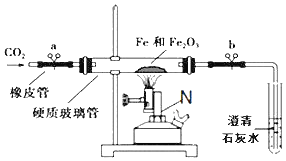
题目内容
【题目】实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取5g稀硫酸样品,将溶质质量分数为5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
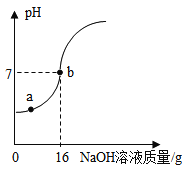
(1)a点溶液中含有的主要离子是_____(填名称或化学符号均可)。
(2)计算稀硫酸中溶质的质量分数。(计算结果精确至0.1%)
【答案】(1)钠离子、氢离子、硫酸根离子;(2)19.6%
【解析】
(1)由图示可知,在a点时溶液的pH小于7,说明加入的NaOH完全反应,有剩余的硫酸,所以,溶液中含有的离子为:Na+、H+、SO42-;
(2)由图示可知,在溶液的pH等于7时,消耗的NaOH溶液的质量为16g,溶质的质量为:16g×5%=0.8g;
设参加反应的硫酸的质量为x
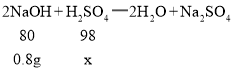
![]() x=0.98g
x=0.98g
稀硫酸中溶质的质量分数: ![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组查阅资料获得以下信息:
①钾、钙、钠等活泼金属能和冷水发生反应,且能在CO2气体中燃烧。
③氧化钠和水反应生成氢氧化钠。该小组同学将钠置于充满CO2的集气瓶中进行燃烧,反应后集气瓶内有黑色固体和白色固体生成。
(1)若钠着火,可以选用的灭火物质是____(填字母序号)。
A 水 B 泡沫灭火剂 C 干沙土 D 二氧化碳
(2)该小组同学经分析得知,白色固体中不可能有NaOH,原因是_________。
他们对白色物质的成分进一步进行讨论并提出了如下假设:
Ⅰ.白色物质是Na2O;
Ⅱ.白色物质是Na2CO3;
Ⅲ.白色物质还可能是Na2O和Na2CO3。
(3)为确定瓶内白色物质的成分,该小组进行了如下实验:
实验步骤 | 实验现象 |
a.取少量白色物质于试管中,加入适量水,振荡 | 样品全部溶于水 |
b.向上述所得溶液中加入过量的CaCl2溶液,静置 | 出现白色沉淀 |
c.取静置后的上层清液于试管中,滴加无色酚酞溶液 | 无明显现象 |
①对上述实验的分析,你认为上述三个假设中,__(填“I”" II”或“Ⅲ”)成立。
②写出实验步骤b中反应的化学方程式:________。
③钠在CO2中燃烧的化学方程式为_____________。
【题目】实验室里有一瓶常用的无色液体试剂,因保管不当造成标签破损(如图所示),其残缺的标签中只剩下“Na”和“10%”字样。小强和小华同学对此很兴趣,决定对其成分进行探究。
(提出问题)该瓶试剂到底是什么物质的溶液呢?
(查阅资料)I.初中化学中常见的含钠化合物有:NaCl、NaOH、Na2CO3、NaHCO3。
II.Na2CO3和NaHCO3的水溶液都呈碱性。
Ⅲ.测定室温(20C)时,四种物质的溶解度数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 205 | 9.6 |
(得出结论)小华根据试剂瓶标签上标注的溶质质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是____溶液。
(作出猜想)①可能是NaCl溶液;②可能是Na2CO3溶液;③可能是_____溶液;
(设计方案并实验)
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,则这瓶试剂不可能是NaCl溶液。
(2)小强为了进一步验证猜想,他又进行了如下实验:
操作步骤 | 实验现象 | 结论 |
①取样品于试管中,滴加_____ | 产生大量气泡 | 猜想②正确 |
②把产生的气体通入澄清石灰水中 | 有白色沉淀产生 |
(拓展与应用)请你选择与小强不同的试剂来验证猜想②成立,你选择____溶液。