题目内容
(8分)小明在学习金属活动性顺序时,对阅读资料上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”这句话产生了好奇。为什么用“一般”这个词呢?难道还有例外吗?
[查阅资料]
①在实验室中,金属钠保存在煤油中。钠的化学性质活泼,常温下与氧气反应,也可以与水反应并放出氢气。
②含有铜元素的碱及盐的水溶液一般显蓝色。
[实验与分析]
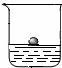
①用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入蒸馏水中(右图),发现钠立刻熔化成银白色小球,在水面上游动;在反应后的溶液中滴入酚酞,溶液变成红色。
②若向硫酸铜水溶液中,投入一小块钠,会有蓝色沉淀[Cu(OH)2]产生,但没有红色物质析出。
⑴金属钠保存在煤油中的原因是________。
⑵从实验①中,你能得出金属钠的物理性质有(任写两条)__________, _________。
⑶写出钠与水反应的化学方程式___________。
⑷将金属钠放到硫酸铜溶液中有蓝色沉淀产生的原因是___________。
[得出结论]
活动性较强的金属不一定都能够将位于其后面的金属从它们的盐溶液中置换出来。
[知识拓展]
⑸查阅资料可知:在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与无色硝酸溶液反应,其化学方程式为Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2 ↑ +2H2O。反应生成的NO2是红棕色、有刺激性气味的有毒气体。
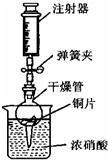
可用右图所示装置进行实验,请回答:
①打开弹簧夹,用注射器慢慢抽取干燥管内的气体,浓硝酸沿着干燥 管慢慢上升,直到硝酸与铜片接触,停止抽拉注射器,关闭弹簧夹,观察干燥管内的现象是 ;
②上述实验完成后,须用足量NaOH溶液将气体吸收,其目的是 。
⑴ 可以防止钠与氧气和水反应 ⑵ 质软熔点低密度小等。
⑶ 2Na +2H2O ="=" 2NaOH + H2↑
⑷ 金属钠与水反应生成的氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀。
⑸ ①铜片溶解,有红棕色气体产生,溶液由无色变成蓝色,液面下降。
②防止污染空气
解析试题分析:(1)根据题干提供的信息可知,钠的化学性质活泼,常温下与氧气反应,也可以与水反应并放出氢气,所以钠在存放时应隔绝氧气和水。
(2)从实验①中:用小刀切下一小块,说明钠比较软;投入蒸馏水中,发现钠立刻熔化成银白色小球,说明钠的熔点低且颜色为银白色;在水面上游动说明钠的密度比水小。
(3)在反应后的溶液中滴入酚酞,溶液变成红色,说明反应后生成碱性物质,根据质量守恒定律可推之为NaOH,根据题意可知,反应同时还生成氢气,所以钠与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑。
(4)将钠放入硫酸铜溶液中会发生两个反应,首先是钠与水反应生成氢氧化钠,生成的氢氧化钠再与硫酸铜反应生成蓝色沉淀。
(5)①根据题意,铜虽然不能置换出酸中的氢,但是可与强氧化性酸反应,如浓硫酸或硝酸,所以当硝酸与铜片接触后即开始反应,可以看到的现象有:铜片因反应而慢慢溶解,同时溶液由无色变成蓝色;而由于生成的NO2是红棕色气体,所以干燥管内气体颜色会变红。
②由于二氧化氮有毒,需要除去,而二氧化氮属于酸性气体,故可用氢氧化钠溶液吸收,防止造成污染。
考点:金属活动性的探究,实验探究物质的性质或变化规律,化学性质与物理性质的差别及应用,反应现象和本质的联系
点评:在金属活动性顺序中,位于前面的金属可以将位于其后面的金属从它们的盐溶液中置换出来,这条规律并不是对所有的金属都适用,钾、钙、钠三种金属例外,因为这三种金属的活动性强,可以与水发生化学反应。位于氢后面的金属不能置换出酸中氢,并不意味着与酸不发生化学反应。所以同学们在学习化学的时候不可死记化学反应的规律,还应注意特例。