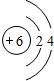题目内容
化学是研究物质的结构、性质以及变化规律的科学,研究元素知识是学好化学的基础.下表包含部分元素的相关信息,完成以下填空:
(1)1869年,科学家
(2)请画出16号元素原子结构示意图
 ,该元素在化学反应中比较容易
,该元素在化学反应中比较容易
(3)元素周期表同一横行元素的排列规律是:从左至右
(4)表中不同种元素最本质的区别是
A.质子数不同 B.相对原子质量不同 C.中子数不同
(5)元素的化学性质与原子结构中的
| 第一周期 | 1H |
2He | ||||||
| 第二周期 | 3Li |
4Be |
5B |
6C |
7N |
8O |
9F |
10Ne |
| 第三周期 | 11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
18Ar |
门捷列夫
门捷列夫
发现了元素周期律和元素周期表.(2)请画出16号元素原子结构示意图


得到
得到
(填“得到”或“失去”)电子变成离子,它的离子符号为S2-
S2-
.(3)元素周期表同一横行元素的排列规律是:从左至右
原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等)
原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等)
(4)表中不同种元素最本质的区别是
A
A
(填字母)A.质子数不同 B.相对原子质量不同 C.中子数不同
(5)元素的化学性质与原子结构中的
最外层电子
最外层电子
数关系密切.分析:(1)根据科学家们在科学上做出的贡献,进行解答.
(2)16号元素的原子是硫原子,核内质子数为16,第一层上有2个电子,第二层上有8个电子,第三层上有6个电子,画出其原子结构示意图即可.
(3)根据元素周期表同一横行元素的原子序数、核外电子层数等的排列规律进行分析解答.
(4)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的粒子是质子数.
(5)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切进行分析解答.
(2)16号元素的原子是硫原子,核内质子数为16,第一层上有2个电子,第二层上有8个电子,第三层上有6个电子,画出其原子结构示意图即可.
(3)根据元素周期表同一横行元素的原子序数、核外电子层数等的排列规律进行分析解答.
(4)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的粒子是质子数.
(5)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切进行分析解答.
解答:解:(1)1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表.
(2)16号元素的原子是硫原子,核内质子数为16,第一层上有2个电子,第二层上有8个电子,第三层上有6个电子,其原子结构示意图为: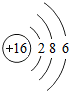 .最外层电子数是6,大于4,在化学反应中易得到2个电子而形成阴离子,其离子符号为:S2-.
.最外层电子数是6,大于4,在化学反应中易得到2个电子而形成阴离子,其离子符号为:S2-.
(3)元素周期表同一横行元素的排列规律是从左至右原子原子序数依次递增、各元素原子的电子层数相同等.
(4)根据元素的概念,元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的粒子是质子数,不同种元素最本质的区别是质子数不同.
(5)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决定元素化学性质的是最外层电子数.
故答案为:(1)门捷列夫;(2)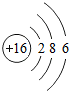 ;得到;S2-;(3)原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等);(4)A;(5)最外层电子.
;得到;S2-;(3)原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等);(4)A;(5)最外层电子.
(2)16号元素的原子是硫原子,核内质子数为16,第一层上有2个电子,第二层上有8个电子,第三层上有6个电子,其原子结构示意图为:
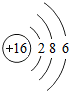 .最外层电子数是6,大于4,在化学反应中易得到2个电子而形成阴离子,其离子符号为:S2-.
.最外层电子数是6,大于4,在化学反应中易得到2个电子而形成阴离子,其离子符号为:S2-.(3)元素周期表同一横行元素的排列规律是从左至右原子原子序数依次递增、各元素原子的电子层数相同等.
(4)根据元素的概念,元素是具有相同核电荷数(即核内质子数)的一类原子的总称,决定元素种类的粒子是质子数,不同种元素最本质的区别是质子数不同.
(5)元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,决定元素化学性质的是最外层电子数.
故答案为:(1)门捷列夫;(2)
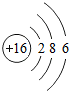 ;得到;S2-;(3)原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等);(4)A;(5)最外层电子.
;得到;S2-;(3)原子序数依次递增(或同一横行从左到右,各元素原子的电子层数相同等);(4)A;(5)最外层电子.点评:本题难度不大,考查学生灵活运用元素周期表中元素的信息、原子结构示意图的含义进行分析、解题的能力.

练习册系列答案
相关题目