题目内容
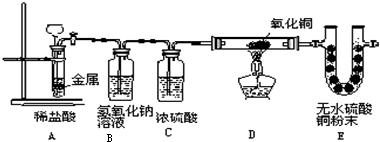
如图,将一块金属放在盛稀盐酸的反应器中,反应发生一定时间后在装置D处加热,稍后可见装置E中的白色无水硫酸铜粉末变蓝.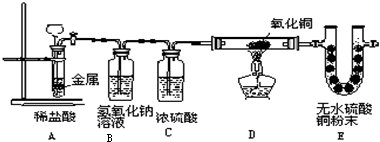
试回答下列问题:
(1)E中白色的无水硫酸铜变蓝,说明D中反应物有
(2)从E中的变化证明装置A一定有
(3)写出装置D中发生反应的化学方程式
(4)A中反应发生的前提是
(5)B装置的作用是

试回答下列问题:
(1)E中白色的无水硫酸铜变蓝,说明D中反应物有
水
水
,写出E中变化的化学方程式CuSO4+5H2O=CuSO4?5H2O
CuSO4+5H2O=CuSO4?5H2O
.(2)从E中的变化证明装置A一定有
氢气
氢气
生成.(3)写出装置D中发生反应的化学方程式
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
.
| ||
(4)A中反应发生的前提是
金属的活动性必须排在氢的前面
金属的活动性必须排在氢的前面
.(5)B装置的作用是
除掉生成气体中可能混有的氯化氢气体
除掉生成气体中可能混有的氯化氢气体
C装置的作用是干燥氢气
干燥氢气
.分析:(1)依据硫酸铜可与水结合生成五水硫酸铜解决;
(2)从氧化铜与气体反应生成水分析A中生成的气体;
(3)依据氢气还原氧化铜的原理书写方程式;
(4)根据金属活动性顺序表的相关应用分析解决;
(5)依据氢氧化钠可与盐酸发生中和反应,浓硫酸是常用的干燥剂分析判断;
(2)从氧化铜与气体反应生成水分析A中生成的气体;
(3)依据氢气还原氧化铜的原理书写方程式;
(4)根据金属活动性顺序表的相关应用分析解决;
(5)依据氢氧化钠可与盐酸发生中和反应,浓硫酸是常用的干燥剂分析判断;
解答:解:(1)因为硫酸铜可与水结合生成五水硫酸铜而使固体变蓝,所以可证明D装置内生成了水,其方程式为:CuSO4+5H2O=CuSO4?5H2O;
(2)从氧化铜与气体反应生成水可知:通入的气体必是氢气,因为氢气与氧化铜反应会生成水;
(3)D装置中发生的反应是氢气还原氧化铜,其方程式为:H2+CuO
Cu+H2O;
(4)根据金属活动性顺序表的相关应用可知只有金属的活动性排在氢的前面的金属,才能和盐酸反应生成氢气;
(5)依据氢氧化钠可与盐酸发生中和反应可知B装置的作用是除掉生成气体中可能混有盐酸溶液挥发出的氯化氢气体,浓硫酸是常用的干燥剂,所以此处C装置的作用是干燥氢气.
故答案为::(1)水;CuSO4+5H2O=CuSO4?5H2O;
(2)氢气;
(3)H2+CuO
Cu+H2O;
(4)金属的活动性必须排在氢的前面;
(5)除掉生成气体中可能混有的氯化氢气体;干燥氢气.
(2)从氧化铜与气体反应生成水可知:通入的气体必是氢气,因为氢气与氧化铜反应会生成水;
(3)D装置中发生的反应是氢气还原氧化铜,其方程式为:H2+CuO
| ||
(4)根据金属活动性顺序表的相关应用可知只有金属的活动性排在氢的前面的金属,才能和盐酸反应生成氢气;
(5)依据氢氧化钠可与盐酸发生中和反应可知B装置的作用是除掉生成气体中可能混有盐酸溶液挥发出的氯化氢气体,浓硫酸是常用的干燥剂,所以此处C装置的作用是干燥氢气.
故答案为::(1)水;CuSO4+5H2O=CuSO4?5H2O;
(2)氢气;
(3)H2+CuO
| ||
(4)金属的活动性必须排在氢的前面;
(5)除掉生成气体中可能混有的氯化氢气体;干燥氢气.
点评:此题是一道实验综合题,主要是对硫酸铜浓硫酸及氢气还原氧化铜实验的考查,属基础性知识考查题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目