题目内容
我国大约在南北朝时就能铸造铜锌合金-黄铜.某化学兴趣小组为了测定得到的黄铜样品中铜的含量,称取20g样品研细后放置于烧杯中,加入50g稀硫酸,恰好完全反应后,冷却,称得烧杯的总质量为69.8g.请计算(计算结果精确到0.1%):(1)此黄铜中铜的质量分数;
(2)所得溶液的溶质质量分数.
【答案】分析:黄铜中的锌与稀硫酸反应生成氢气而铜不与稀硫酸反应.
(1)根据质量守恒定律解出氢气的质量,然后再根据方程式中的比例关系求解锌的质量;
(2)根据质量守恒定律解答反应后溶液的质量,利用方程式解答反应后溶质质量,最后解溶质质量分数.
解答:解:由质量守恒定律得,反应所生成的氢气为:20g+50g-69.8g=0.2g
(1)设此黄铜中锌的质量为x,反应消耗H2SO4的质量为y,生成ZnSO4的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x y z 0.2g
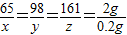
x=6.5g
y=9.8g
z=16.1g
此黄铜样品中铜的质量为:20g-6.5g=13.5g,
此黄铜样品中铜的质量分数为: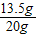 ×100%=67.5%,
×100%=67.5%,
(2)反应后溶液的质量是:69.8g-13.5g=56.3g
所得溶液的溶质质量分数为: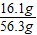 ×100%≈28.6%,
×100%≈28.6%,
答:此黄铜中铜的质量分数是67.5%,所得溶液的溶质质量分数是28.6%.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.解题时要知道铜与稀硫酸不反应,铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应.然后根据化学方程式进行计算,问题即可迎刃而解.
(1)根据质量守恒定律解出氢气的质量,然后再根据方程式中的比例关系求解锌的质量;
(2)根据质量守恒定律解答反应后溶液的质量,利用方程式解答反应后溶质质量,最后解溶质质量分数.
解答:解:由质量守恒定律得,反应所生成的氢气为:20g+50g-69.8g=0.2g
(1)设此黄铜中锌的质量为x,反应消耗H2SO4的质量为y,生成ZnSO4的质量为z
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
x y z 0.2g
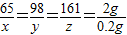
x=6.5g
y=9.8g
z=16.1g
此黄铜样品中铜的质量为:20g-6.5g=13.5g,
此黄铜样品中铜的质量分数为:
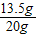 ×100%=67.5%,
×100%=67.5%,(2)反应后溶液的质量是:69.8g-13.5g=56.3g
所得溶液的溶质质量分数为:
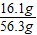 ×100%≈28.6%,
×100%≈28.6%,答:此黄铜中铜的质量分数是67.5%,所得溶液的溶质质量分数是28.6%.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.解题时要知道铜与稀硫酸不反应,铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应.然后根据化学方程式进行计算,问题即可迎刃而解.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目