题目内容
我县石灰石资源丰富,某镇为开发本地石灰石资源,招商广告称:“本镇石灰石资源丰富,品质优越,碳酸钙含量不低于80%”.一投资商派技术员到实地取回样品,从中称取12.5g与一定量质量的稀盐酸恰好完全反应(杂质不参加反应),测得生成的二氧化碳质量为4.4g.根据检测获得的数据计算和判断:
(1)样品中碳酸钙的质量分数.(2)该广告的真实性.
解:设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
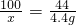 x=10g
x=10g
样品中碳酸钙的质量分数= ×100%=80%
×100%=80%
广告中“碳酸钙含量不低于80%”的宣传真实
答:(1)样品中碳酸钙的质量分数80%;
(2)该广告是真实的.
分析:碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,利用反应产生的二氧化碳气体的质量可计算参加反应的盐酸的质量及碳酸钙的质量;
利用样品中碳酸钙的质量分数=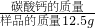 ×100%,可求得样品中碳酸钙的质量分数,并与广告中碳酸钙含量进行比较,以判断广告的真实性.
×100%,可求得样品中碳酸钙的质量分数,并与广告中碳酸钙含量进行比较,以判断广告的真实性.
点评:利用反应的化学方程式表示物质的质量关系,根据反应中某一物质的质量可计算反应中其它任何物质的质量.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 4.4g
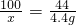 x=10g
x=10g样品中碳酸钙的质量分数=
 ×100%=80%
×100%=80%广告中“碳酸钙含量不低于80%”的宣传真实
答:(1)样品中碳酸钙的质量分数80%;
(2)该广告是真实的.
分析:碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,根据反应的化学方程式,利用反应产生的二氧化碳气体的质量可计算参加反应的盐酸的质量及碳酸钙的质量;
利用样品中碳酸钙的质量分数=
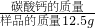 ×100%,可求得样品中碳酸钙的质量分数,并与广告中碳酸钙含量进行比较,以判断广告的真实性.
×100%,可求得样品中碳酸钙的质量分数,并与广告中碳酸钙含量进行比较,以判断广告的真实性.点评:利用反应的化学方程式表示物质的质量关系,根据反应中某一物质的质量可计算反应中其它任何物质的质量.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目