题目内容
【题目】为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如下图所示的实验.下列分析和结论正确的是( ) 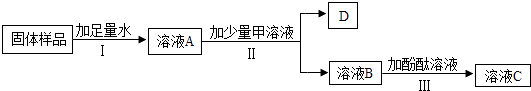
A.若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质
B.若D为白色固体,则溶液A是Na2CO3溶液.
C.若D为气体,则加入甲溶液的目的是证明样品已变质.
D.若D为白色固体,且溶液C为红色,则样品一定是部分变质.
【答案】C
【解析】解:A、如果氢氧化钠没有变质,则溶液A是氢氧化钠溶液,加入少量氯化镁溶液时,氢氧化钠和氯化镁反应能生成氢氧化镁沉淀和氯化钠,剩余的氢氧化钠溶液能使酚酞试液变红色,Ⅱ、Ⅲ均有明显现象.不正确. B、如果溶液A是氢氧化钠溶液,加入少量氯化镁溶液时,氢氧化钠和氯化镁反应能生成氢氧化镁沉淀和氯化钠,氢氧化镁沉淀是白色的,溶液A不一定是碳酸钠溶液.不正确.
C、若D为气体,则D是二氧化碳,是变质生成的碳酸钠和稀盐酸或稀硫酸反应生成的,加入的溶液甲是稀盐酸或稀硫酸,通过产生气体可以判断样品已变质.正确.
D、如果氢氧化钠完全变质,则溶液A是碳酸钠溶液,加入氯化钙或氯化钡溶液时,碳酸钠能和氯化钙或氯化钡反应生成碳酸钙沉淀或碳酸钡沉淀,剩余的碳酸钠溶液能使酚酞试液变红色,所以D为白色固体,且溶液C为红色,样品不一定是部分变质.不正确.
故选:C.

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】分类和类比是学习化学常用的方法.
(1)化学实验按其研究内容可分为:化学基本操作的实验、物质的性质的实验、揭示化学基本概念和原理(定律)的实验等. 据此应将下列实验中的B与(填两项)归为一类,依据是 .
|
|
|
|
|
A | B | C | D | E |
(2)通过观察表格中的信息,根据元素的化合价与原子的最外层电子数的关系,你能发现有关元素化合价的规律是 . 应用此规律你能推测出磷元素的最低负价是 , 磷酸中磷元素显+5价,则磷酸的化学式为 .
元素名称 | 最高正化合价 | 最低负化合价 |
硫 | +6 | ﹣2 |
氯 | +7 | ﹣1 |
【题目】我国青海湖采集的天然碱样品可表示为aNa2CO3bNaHCO3cH2O(a、b、c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: 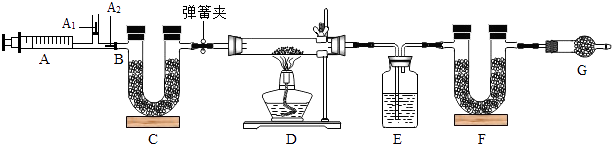
已知:碳酸钠比较稳定,加热时不分解;2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
(一)实验步骤 ①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量 ④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
(二)问题探究:
(1)E中的药品为 , E的作用是 . C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 , G的作用是 .
(2)实验步骤②与③能否颠倒(填“能”或“不能”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是; 若没有G装置,则碳酸氢钠的质量(填“偏大”、“偏小”、“无影响”).
(3)据下表回答下列问题:
反应前 | 反应后 |
E的质量为100.0g | E的质量为102.25g |
F的质量为50.0g | F的质量为51.1g |
①碳酸氢钠分解生成二氧化碳的质量为g,
②碳酸氢钠的质量为g
③结晶水的质量为g
④Na2CO3的质量为g,
⑤该天然碱的化学式中a:b:c= .
【题目】下列数据是氯化钠和氯化钾固体在不同温度时的溶解度.
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 | |
(1)在0~20℃时,KCl的溶解度(填“>”或“<”)NaCl的溶解度;
(2)20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为(填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为;
(3)20℃时,进行如下图所示的实验. 
①A~E中,溶液中溶质质量分数相同的是;
②下列操作能使E溶液中溶质质量分数变小的是(填字母序号).
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃