题目内容
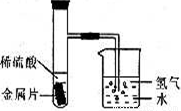
Ⅰ某自然科学兴趣小组设计了如下图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同溶质质量分数的稀硫酸反应,观察在30s里从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多)| 金属 | 甲 | 乙 | 丙 | 丁 |
| 氢气泡的多少 | ++ | ++++ | +++ | + |
(2)如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是______
Ⅱ甲同学为了探究铝、铁和铜三种金属的活动性,他用铜丝、铁丝、铝丝和稀盐酸四种物质,设计了以下只用一支试管,取一次盐酸的探究方案.
请你帮助甲同学完善下表中的探究方案.
| 实验步骤 | 实验现象 |
| ①在试管里取少量盐酸,插入铁丝,充分作用 | 溶液由无色变为浅绿色,有大量气体生成 |
| ②在①所得的溶液中,插入______,充分作用 | 无明显现象 |
| ③在②所得溶液中,插入______,充分作用 | 金属铝表面有一层,黑色物质生成 |
【答案】分析:Ⅰ、(1)利用表格中的记录可判断气泡的多少来得出金属的活泼性强弱;
(2)镁、铝、铁、锌的活泼性为:镁>铝>锌>铁,判断丁为铁;
Ⅱ、分析探究实验的设计思路:根据实验步骤可推知,先使铁与盐酸反应检验铁的活动性同时得到氯化亚铁溶液,然后分别使铝、铜与所得溶液进行反应,验证铝、铜的活动性;根据金属活动性预计实验中出现的现象,并完成探究实验中的操作;
解答:解:Ⅰ、(1)气泡的多少可说明反应进行的快慢,根据表格中的记录可知:金属的活泼性为乙>丙>甲>丁,
(2)镁、铝、铁、锌的活泼性为:镁>铝>锌>铁,则丁最有可能是铁.
Ⅱ、②由实验现象为无现象,说明插入的金属不能与氯化亚铁溶液反应,根据金属活动性,插入的金属应为铜;
故答案为:铜丝;
③为检验铝的活动性比铁强,把铝丝插入硫酸亚铁溶液,在铝表面会出现铁,生成的氯化铝溶液无色,故答案为:铝丝;
排在氢气的金属能把酸中的氢置换出来,所以根据金属活动性,铁与盐酸发生置换反应,生成+2价亚铁盐同时放出氢气;故答案为:Fe+H2SO4=FeSO4+H2↑;
点评:检验三种金属的活动性,一般采取“三取中”的做法:即取活动性处于中间的金属分别与另两种金属的盐溶液反应或取其盐溶液分别与另外两种金属反应.
(2)镁、铝、铁、锌的活泼性为:镁>铝>锌>铁,判断丁为铁;
Ⅱ、分析探究实验的设计思路:根据实验步骤可推知,先使铁与盐酸反应检验铁的活动性同时得到氯化亚铁溶液,然后分别使铝、铜与所得溶液进行反应,验证铝、铜的活动性;根据金属活动性预计实验中出现的现象,并完成探究实验中的操作;
解答:解:Ⅰ、(1)气泡的多少可说明反应进行的快慢,根据表格中的记录可知:金属的活泼性为乙>丙>甲>丁,
(2)镁、铝、铁、锌的活泼性为:镁>铝>锌>铁,则丁最有可能是铁.
Ⅱ、②由实验现象为无现象,说明插入的金属不能与氯化亚铁溶液反应,根据金属活动性,插入的金属应为铜;
故答案为:铜丝;
③为检验铝的活动性比铁强,把铝丝插入硫酸亚铁溶液,在铝表面会出现铁,生成的氯化铝溶液无色,故答案为:铝丝;
排在氢气的金属能把酸中的氢置换出来,所以根据金属活动性,铁与盐酸发生置换反应,生成+2价亚铁盐同时放出氢气;故答案为:Fe+H2SO4=FeSO4+H2↑;
点评:检验三种金属的活动性,一般采取“三取中”的做法:即取活动性处于中间的金属分别与另两种金属的盐溶液反应或取其盐溶液分别与另外两种金属反应.

练习册系列答案
相关题目
 13、某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多). 13、某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多).
|
某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多).
如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是( )

A.镁
B.铝
C.铁
D.锌
| 金属 | 甲 | 乙 | 丙 | 丁 |
| 氢气泡多少 | ++ | ++++ | +++ | + |

A.镁
B.铝
C.铁
D.锌
某自然科学兴趣小组,设计了如图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同质量分数的稀硫酸反应,观察30s内从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多).
如果四种金属分别是镁、铝、铁、锌中的一种,则丁最有可能是( )
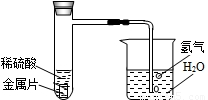
A.镁
B.铝
C.铁
D.锌
| 金属 | 甲 | 乙 | 丙 | 丁 |
| 氢气泡多少 | ++ | ++++ | +++ | + |

A.镁
B.铝
C.铁
D.锌

 Ⅰ某自然科学兴趣小组设计了如下图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同溶质质量分数的稀硫酸反应,观察在30s里从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多)
Ⅰ某自然科学兴趣小组设计了如下图所示的装置,用来研究不同金属跟稀硫酸反应的快慢.他们用此装置,选择了甲、乙、丙、丁四种大小相同的金属片,分别与相同体积、相同溶质质量分数的稀硫酸反应,观察在30s里从导管口冒出的氢气泡多少,记录在下表中.(“+”越多表示产生的气泡越多)