题目内容
【题目】电池是日常必备用品之一,但它也是环境污染的一个重要来源。下面是某兴趣小组利用废旧锌锰干电池作为原料,并进行相关探究的过程。
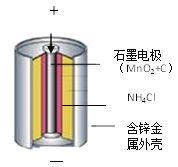
(知识储备)(1)锌锰电池的构造和组成(见图)。
(2)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,如蓝色的胆矾晶体(CuSO4 5H2O)受热时可失去结晶水变为白色的无水硫酸铜粉末(CuSO4)。
I.制备皓矾晶体(ZnSO4xH2O)
小组同学参观了某回收废旧锌锰电池的工厂,其回收工艺流程如图:

⑴流程图中试剂a的化学式是__________;得到的滤液1农业上可用作_____________。
(2)将滤渣B在空气中充分灼烧 可提纯制得的固体是___________,该方法提纯的原理是(用化学方程式回答)____________________________。
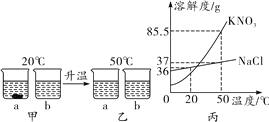
⑶将滤液2中溶质主要是硫酸锌,其有关溶解度和温度关系如下表,
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
将滤液2蒸发浓缩、__________,可得到皓矾晶体(ZnSO4xH2O)。
II.皓矾晶体中结晶水含量的测定
小组同学将部分皓矾晶体(ZnSO4xH2O)带回实验室,用下图装置测定晶体中结晶水的含量(图中半透膜可让气体通过又可防止固体粉末进入导管)。

测定方法:称取28.7g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水:(ZnSO4xH2O == ZnSO4 + xH2O),冷却至常温后,称量玻璃管中固体其质量为16.1g。
⑷A中的化学方程式是_____________,B中的试剂可从下列物质中选取,你的选择是__________________。
A.浓硫酸 B.硝酸银溶液 C.饱和碳酸钠溶液 D.澄清石灰水
⑸实验过程中若不通入CO2测得的结果将________(填“偏大”、 “偏小”或“无影响”)。
根据实验结果,计算皓矾晶体中结晶水的x值。计算过程:__________________
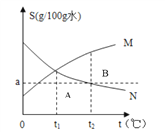
⑹将上述皓矾晶体加热会逐渐失去部分结晶水,加热过程中有关残留固体质量如下图,写出D-E段发生反应的化学方程式________________

【答案】 H2O 氮肥 MnO2 C + O2 === CO2 冷却结晶 H2SO4 + 2NaHCO3 == Na2SO4 +2H2O + 2CO2 ↑ A 偏小 7 ZnSO4·H2O == ZnSO4 + H2O
【解析】本题以制备皓矾晶体、皓矾晶体中结晶水含量的测定为情境主要考查了物质的溶解,结晶,物质与氧气的反应,浓硫酸的性质,化学方程式的书写和化学计算,综合较强。
(1)固体混合物A中主要成分应NH4Cl、C、二氧化锰,其中氯化铵溶于水,碳和二氧化锰不溶,加水后氯化铵溶解其余的成分不溶,流程图中试剂a的化学式是水;得到的滤液1中含有NH4Cl,农业上可用作氮肥;
(2)滤渣中含有二氧化锰和碳,灼烧过程碳和空气中的氧气反应生成二氧化碳从而除去碳,化学方程式是:C + O2点燃CO2;
(3)结晶水合物的特殊性质:在逐步升高温度条件下,结晶水合物能失去部分或者全部结晶水,硫酸锌的溶解度随温度的降低而减小。将滤液2蒸发浓缩、降温结晶,可得到皓矾晶体(ZnSO4xH2O);
(4)A中碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是CaCO3+2HCl==CaCl2+H2O+CO2↑;实验的目的是测定皓矾中结晶水的含量,不能使水蒸气随二氧化碳进入碱石灰中,所以B中的试剂具有吸水性,题中物质中只有浓硫酸具有吸水性,故选A;
(5)实验过程中若不通入CO2,则最后称量玻璃管中固体偏重,所得中结晶水的质量偏小,使测定的结果偏小;28.7g皓矾晶体中结晶水的质量为28.7g-16.1g=12.6g,ZnSO4质量为16.1g,则有161:18x=16.1g :12.6g,x=7;
⑹皓矾晶体加热会逐渐失去部分结晶水,D-E段产生的水的质量为17.9g-16.1g=1.8g。反应的化学方程式是ZnSO4H2O == ZnSO4 + H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如下图是某品牌陈醋的部分标签。

(1)原料“糯米、大米”的主要成分都是___________;
A.碳水化合物 B.油油脂 C.蛋白质
(2)原料中的食盐由构成____________;
A.分子 B.原子 C.离子
(3)用陈醋在铁锅中烹任糖醋排骨时,写出醋酸(HAc)与铁发生反应的化学方程式:___________
(4)已知食醋的等级按下表划分,这瓶陈醋的等级_____________(填:特级、优级、一级、二级)
等级 | 特级 | 优级 | 一级 | 二级 |
总酸g/100mL | ≥6.00 | 5.50~5.99 | 5.00~5.49 | 4.50~4.99 |
(5)请根据所学知识再补充一个该陈醋的贮存条件___________________________________。
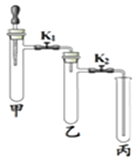
【题目】利用表中装置进行下列实验。
实验装置 | 实验1 | 实验2 |
| ①甲试管中放入少量MnO2,滴管中放入过氧化氢溶液,乙、丙中分别放入一小块白磷依次加入适量80℃的水,白磷均不燃烧 ②打开K1、K2,将过氧化氢溶液滴入试管,观察到乙试管中白磷不燃烧,丙中白磷燃烧 ③一段时间后,丙中导管内液 面上升 | ①关闭K1,打开K2,甲试管中充满CO2,滴管中放入浓NaOH溶液;乙试管中放入适量铁粉,丙中放入约半试管稀盐酸 ②将浓NaOH溶液滴入甲试管中,一段时间后,打开K1 ③一段时间后,观察乙、丙试管中的现象 |
(1)实验1:甲中发生反应的化学方程式是_______________,对比乙和丙中的实验现象,本实验欲探究的燃烧条件是_____________;步骤③中“丙中导管内液面上升”的原因是________________。
(2)实验2:甲中发生反应的化学方程式为____________;步骤③乙中的现象是_____________;丙试管中的现象是_________。
【题目】分液漏斗是化学实验室一种常用的仪器,可用于滴加液体或分离互不相溶的两种液体,实验室部分装置如A~D所示。
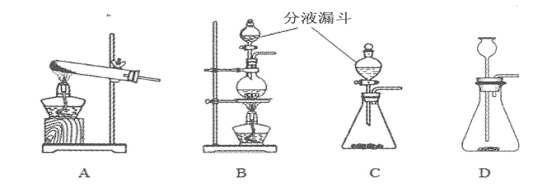
(1)实验室用KMnO4制取O2的化学方程式为 。
(2)实验室制取气体通过反应物状态,反应条件等选用相应的反应装置,请完成下表空格。
制取的气体 | 反应物 | 反应条件 | 反应装置(填字母) |
O2 | KClO3固体 | 催化剂MnO2固体、加热 | |
H2O2溶液 | 催化剂MnO2固体、常温 | C或D | |
CO2 | 和 | 常温 | 或 |
N2 | NH4Cl饱和溶液与NaNO2 饱和溶液 | 加热 |
(3)关于装置C和D的下列说法正确的是 。(双项选择)
A.装置C发生反应时,分液漏斗下端必须浸没在液体中。
B.装置D发生反应时,长颈漏斗下端必须浸没在液体中
C.装置C和D的气密性检查的操作方法相同
D.装置C和D均可用于制取一定量的H2