题目内容
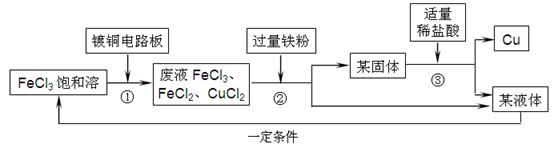
33、氯化铁溶液能与铜反应生成可溶性的氯化铜和氯化亚铁,工业上常用此原理生产印刷线路板.以下是印刷线路板的生产及废液的处理过程:

请回答下列问题:
(1)步骤②③中实验操作的名称是
步骤②实验操作前发生了两个反应:2FeCl3+Fe=3FeCl2和
(2)某固体的成分有
(3)步骤③中适量稀盐酸的标志是
发生反应的化学方程式是
(4)该流程中可以循环、回收利用的物质是

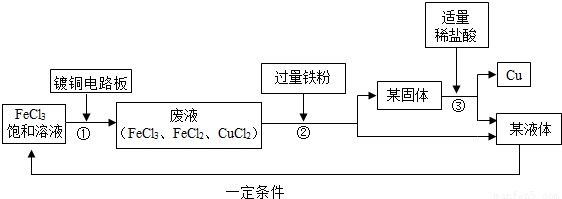
请回答下列问题:
(1)步骤②③中实验操作的名称是
过滤
.步骤②实验操作前发生了两个反应:2FeCl3+Fe=3FeCl2和
Fe+CuCl2=FeCl2+Cu
,(2)某固体的成分有
铁和铜(或Fe、Cu)
.(3)步骤③中适量稀盐酸的标志是
不再产生气泡
;发生反应的化学方程式是
Fe+2HCl=FeCl2+H2↑
.(4)该流程中可以循环、回收利用的物质是
Cu、FeCl2
.分析:由题意可知:(1)加入过量铁粉后能够使得固体和液体分离开的方法就是过滤.②中根据金属活动性顺序,过量铁粉与氯化铁,氯化铜发生化学反应;
(2)过量铁粉与氯化铜反应,所以滤渣的成份有多余的铁和化学反应生成的铜;
(3)加入盐酸后,盐酸只和铁反应生成氢气,当不再产生气泡时说明鉄已经反应完毕;
(4)该流程中可以循环、回收利用的物质,了解金属的回收利用.
(2)过量铁粉与氯化铜反应,所以滤渣的成份有多余的铁和化学反应生成的铜;
(3)加入盐酸后,盐酸只和铁反应生成氢气,当不再产生气泡时说明鉄已经反应完毕;
(4)该流程中可以循环、回收利用的物质,了解金属的回收利用.
解答:解:(1)加入过量铁粉后能够使得固体和液体分离开的方法就是过滤.②中根据金属活动性顺序,过量铁粉与氯化铁,氯化铜发生化学反应;故填:Fe+CuCl2=FeCl2+Cu;
(2)过量铁粉与氯化铜反应,所以滤渣的成份有多余的铁和化学反应生成的铜;故为铁、铜(或Fe、Cu);
(3)加入盐酸后,盐酸只和铁反应生成氢气,当不再产生气泡时说明铁已经反应完毕.故加入适量稀盐酸的标志是:不再产生气泡,反应的化学方程式是:
Fe+2HCl=FeCl2+H2↑;
(4)该流程中可以循环、回收利用的物质:Cu、FeCl2.
故答案为:(1)过滤、Fe+CuCl2=FeCl2+Cu;(2)铁、铜(或Fe、Cu);(3)不再产生气泡、Fe+2HCl=FeCl2+H2↑;(4)Cu、FeCl2.
(2)过量铁粉与氯化铜反应,所以滤渣的成份有多余的铁和化学反应生成的铜;故为铁、铜(或Fe、Cu);
(3)加入盐酸后,盐酸只和铁反应生成氢气,当不再产生气泡时说明铁已经反应完毕.故加入适量稀盐酸的标志是:不再产生气泡,反应的化学方程式是:
Fe+2HCl=FeCl2+H2↑;
(4)该流程中可以循环、回收利用的物质:Cu、FeCl2.
故答案为:(1)过滤、Fe+CuCl2=FeCl2+Cu;(2)铁、铜(或Fe、Cu);(3)不再产生气泡、Fe+2HCl=FeCl2+H2↑;(4)Cu、FeCl2.
点评:熟练利用金属活动性顺序,提纯和回收利用金属;会处理实验流程图.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目