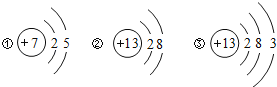题目内容
【题目】铜是一种常见的金属,在生活、生产中有广泛的应用。
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的 性;
(2)铜是一种不活泼的金属,但铜制品长期露置在潮湿空气中,表面变绿色,即生成了“铜绿”[化学式:Cux(OH)yCO3]。
小明和小丽为了探究“铜绿”的组成,查阅资料:“铜绿”受热易分解生成CuO、CO2和H2O。他们进行如下实验:称取22.2克“铜绿”,充分加热至固体质量不再改变,把产生的气体全部依次通过足量浓硫酸和足量氢氧化钠的溶液,发现浓硫酸增重1.8克,氢氧化钠溶液增重4.4克。
根据以上实验,他们推断出:x= ,y= ;
铜与潮湿空气中变成“铜绿”的化学方程式是 ;
(3)小明和小丽分别取24.0克氧化铜,用CO还原制铜,小明得到19.2克红色固体,小丽得到20.8克红色固体。他们质疑:为什么两人得到的红色固体质量不相等?
查阅资料:
Ⅰ.CO还原CuO时也可产生红色的氧化亚铜(Cu2O)
Ⅱ.Cu2O+H2SO4(稀)═Cu+CuSO4+H2O
他们分析推断:
①一致认为 (填“小明”或“小丽”)的产物中没有Cu2O;
②用CO还原a克Cuo得到红色固体b克,若红色固体为Cu和Cu2O的混合物,则a与b的数量关系是 ;
③还可以简单的实验验证红色固体是否有Cu2O,请简述操作、现象及结论:
。
【答案】
(1)导电
(2)2 2 2Cu+CO2+O2+H2O═Cu2(OH)2CO3
(3)①小明
②![]() a<b<
a<b<![]() a
a
③可向红色固体中加入少量稀硫酸,若溶液变蓝色,则证明红色固体中含有Cu2O
【解析】
试题分析:
(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的导电性,故填:导电;
(2)铜元素的质量为(22.2g﹣1.8g﹣4.4g)×![]() =12.8g,氢元素的质量为1.8g×
=12.8g,氢元素的质量为1.8g×![]() =0.2g,碳元素的质量为4.4g×
=0.2g,碳元素的质量为4.4g×![]() =1.2g,铜原子和氢原子、碳原子的个数比为
=1.2g,铜原子和氢原子、碳原子的个数比为![]() :
:![]() :
:![]() =2:2:1,结合“铜绿”[化学式:Cux(OH)yCO3]可知,x=2,y=2,铜在潮湿的空气中生成铜绿(Cu2(OH)2CO3)是铜与空气中的水、氧气、二氧化碳共同作用的结果。故答案为:2;2;2Cu+CO2+O2+H2O═Cu2(OH)2CO3;
=2:2:1,结合“铜绿”[化学式:Cux(OH)yCO3]可知,x=2,y=2,铜在潮湿的空气中生成铜绿(Cu2(OH)2CO3)是铜与空气中的水、氧气、二氧化碳共同作用的结果。故答案为:2;2;2Cu+CO2+O2+H2O═Cu2(OH)2CO3;
(3)①小明得到的红色固体轻,因此一致认为小明的产物中没有Cu2O,故填:小明;
②当得到的全部是铜时b=a×![]() =
=![]() a,全部是氧化亚铜时,b=a×
a,全部是氧化亚铜时,b=a×![]() =
=![]() a,若红色固体为Cu和Cu2O的混合物,则a与b的数量关系是
a,若红色固体为Cu和Cu2O的混合物,则a与b的数量关系是![]() a<b<
a<b<![]() a;
a;
③根据题中信息Cu2O+H2SO4(稀)═Cu+CuSO4+H2O可知,可向红色固体中加入少量稀硫酸,若溶液变蓝色,则证明红色固体中含有Cu2O,故填:可向红色固体中加入少量稀硫酸,若溶液变蓝色,则证明红色固体中含有Cu2O。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】蔗糖是生活中常见的一种物质,某兴趣小组对“蔗糖的组成”进行了探究。
【作出猜想】小组同学认为绿色植物通过光合作用将二氧化碳和水转化成葡萄糖和氧气,葡萄糖进一步转化为蔗糖,故蔗糖中一定含有碳、氢元素,可能含有氧元素。
【实验验证】
方案一:小明将蔗糖在氧气中燃烧,检验到生成产物中有水和二氧化碳,得出结论“蔗糖是由碳、氢、氧三种元素组成的”。
小刚认为该方案不合理,只能说明蔗糖中一定含有碳、氢元素,不能确定是否含有氧元素,理由是_______________________。
方案二:小刚用下图所示装置进行实验。实验开始先通入一会儿氮气,然后关闭弹簧夹,点燃酒精灯给蔗糖加强热。
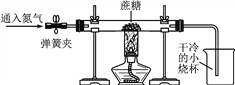
(1)观察到________________________出现,说明蔗糖中含有氢元素和氧元素。
(2)观察到硬质玻璃管中残留有黑色固体,他猜想该黑色固体是单质碳,并继续利用图示装置,另选试剂进行了验证单质碳的实验,实验过程和现象如下:
实验过程 | 实验现象 |
________________,点燃酒精灯 | ①硬质玻璃管中的黑色固体剧烈燃烧,发出白光; ②_____________ |
写出上述实验过程中一个反应的化学方程式:________________________。
【实验结论】蔗糖是由碳、氢、氧三种元素组成的。
【拓展交流】
(1)方案二中,先通入一会儿氮气的原因是___________________________________。
(2)查阅资料得知蔗糖的化学式为C12H22O11。小红发现:蔗糖分子中氢原子的数目是氧原子数目的2倍,但是,蔗糖中氧元素质量却是氢元素质量的8倍,导致出现这种情况的原因是________________________。
【题目】下列实验结论错误的是( )
选项 | A | B | C | D |
实 验 |
|
|
|
|
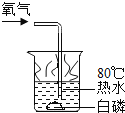
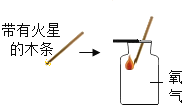
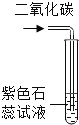
实验 现象 | 通入氧气后热水中的白磷燃烧 | 带火星的木条伸入氧气中复燃 | 紫色石蕊试液在通入二氧化碳后变红 | 燃烧的蜡烛由低到高依次熄灭 |
实验 结论 | 燃烧需要氧气 | 氧气浓度越大,燃烧越剧烈 | 使石蕊变红的是二氧化碳 | CO2密度比空气大,不可燃不助燃 |
A.A B.B C.C D.D