题目内容
【题目】广州亚运会“潮流”火炬外部采取广州市花木棉花的独特红色,体现了运动的力量和激情,火炬的燃料使用清洁能源丙烷,若在规定时间内完全燃烧22g丙烷,生成66gCO2和36gH2O,请通过计算判断丙烷的元素组成是( )
A.丙烷中一定含有碳、氢、氧元素
B.丙烷中一定含有碳和氧元素,可能含有氧元素
C.丙烷中一定只含有碳、氢元素
D.丙烷中一定含有碳、氧元素
【答案】C
【解析】
根据化学反应前后元素的种类不变,参加反应的氧气中有氧元素,反应后生成的二氧化碳和水中有碳、氧、氢元素,可知丙烷中一定有碳、氢元素。根据质量守恒定律,22g丙烷完全燃烧消耗氧气的质量为:![]() ,66gCO2中氧元素的质量为:
,66gCO2中氧元素的质量为:![]() ,36gH2O中氧元素的质量为:
,36gH2O中氧元素的质量为:![]() 。根据计算结果可知,反应前氧气中氧元素的质量=产物二氧化碳中的氧元素质量+产物水中氧元素的质量,可知丙烷中没有氧元素,故丙烷中一定有碳元素和氢元素,一定没有氧元素。故选C。
。根据计算结果可知,反应前氧气中氧元素的质量=产物二氧化碳中的氧元素质量+产物水中氧元素的质量,可知丙烷中没有氧元素,故丙烷中一定有碳元素和氢元素,一定没有氧元素。故选C。

练习册系列答案
相关题目
【题目】某造纸厂排放的废水中含有Na2CO3和NaOH。为测定废水中Na2CO3的质量分数,取50g废水样品于烧杯中,将40g稀盐酸分成4等份分4次缓慢加入到烧杯中,产生气体质量与稀盐酸溶液的质量关系如图曲线所示。回答下列问题:
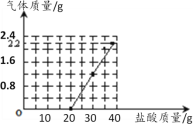
(1)请仔细分析如图数据,完成下表实验记录:
实验次数 | 1 | 2 | 3 | 4 |
稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
生成气体质量(g) | 0 | ____ | ____ | ____ |
(2)上述生成气体________ g。
(3)计算该废水中Na2CO3的质量分数________。
(4)测定Na2CO3的质量分数,也可用下列方法:另取上述废水样品50g,向废水中逐滴加入CaCl2溶液,至反应完全时,经过滤、洗涤、干燥、_________,即可计算出Na2CO3的质量分数。