题目内容
质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:(1)某纯净物X在空气中完全燃烧,反应的化学方程式为:X+3O2
 2CO2+2H2O,X的化学式为______;若生成的二氧化碳质量为8.8g则X中碳元素质量为______g.
2CO2+2H2O,X的化学式为______;若生成的二氧化碳质量为8.8g则X中碳元素质量为______g.(2)下图是某化学变化的微观示意图(不同圆球代表不同原子)根据以上示意图,写出该反应的化学方程式______ H2+CO
【答案】分析:(1)根据反应前后原子个数和种类不变考虑;根据二氧化碳中碳元素的质量就是该物质中碳元素的质量考虑;(2)根据原子个数和构成的分子种类写出化学式.
解答:解:(1)生成物中含有2个C原子,4个H原子,6个O原子;反应物中已经含有6个O原子,所以X中需要含有2个C原子,4个H原子,所以化学式为:C2H4;根据质量守恒定律可知二氧化碳中碳元素都来自于X物质,所以X物质中碳元素质量为:8.8g× ×100%=2.4g;
×100%=2.4g;
(2)根据反应前后没有变化的分子或原子,属于没有参加反应的,所以反应前是一个碳原子和一个水分子,反应后生成了一个一氧化碳分子和一个氢分子,所以化学方程式是:C+H2O H2+CO.
H2+CO.
故答案为:(1)C2H4;2.4;(2)C+H2O H2+CO.
H2+CO.
点评:解答本题关键是要知道反应前后原子种类和个数不变来推算X的化学式,知道根据结构示意图写化学式的方法,关键是要知道没有参加反应的分子或原子的确定方法.
解答:解:(1)生成物中含有2个C原子,4个H原子,6个O原子;反应物中已经含有6个O原子,所以X中需要含有2个C原子,4个H原子,所以化学式为:C2H4;根据质量守恒定律可知二氧化碳中碳元素都来自于X物质,所以X物质中碳元素质量为:8.8g×
 ×100%=2.4g;
×100%=2.4g;(2)根据反应前后没有变化的分子或原子,属于没有参加反应的,所以反应前是一个碳原子和一个水分子,反应后生成了一个一氧化碳分子和一个氢分子,所以化学方程式是:C+H2O
 H2+CO.
H2+CO.故答案为:(1)C2H4;2.4;(2)C+H2O
 H2+CO.
H2+CO.点评:解答本题关键是要知道反应前后原子种类和个数不变来推算X的化学式,知道根据结构示意图写化学式的方法,关键是要知道没有参加反应的分子或原子的确定方法.

练习册系列答案
相关题目
 27、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
27、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究. 16、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
16、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究. (2013?滨州模拟)若用○、
(2013?滨州模拟)若用○、 、
、 、表示不同的原子,这些相同或不相同的原子的组合可以构成不同分子,当用图示表示某个化学反应时,下列说法中,正确的是( )
、表示不同的原子,这些相同或不相同的原子的组合可以构成不同分子,当用图示表示某个化学反应时,下列说法中,正确的是( )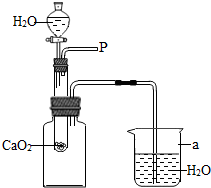 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.