题目内容
【题目】某化学探究小组用稀盐酸与大理石反应研究影响反应剧烈程度的因素。实验温度为25℃、35℃;大理石有细颗粒与粗颗粒两种规格,每次实验取用含碳酸钙60%的大理石10 g;所用稀盐酸的质量分数为9.125%、18.25%,每次实验稀HCl的用量为20mL(假设9.125%、18.25%的盐酸的密度均为1 g/em3;大理石中杂质不与盐酸反应)。
(1)反应原理:实验中的化学方程式__________________________________________ 。
(2)提出假设:稀HCl与大理石反应的剧烈程度与所用稀HCl的质量分数、大理石规格、反应温度有关。
(3)实验设计与实施:完成以下实验设计方案并实验。
实验 编号 | T/℃ | 大理石 规格 | 稀HCl的 质量分数 | 完全反应 的时间/s | 实验目的 |
① | 25 | 粗颗粒 | 18.25% | 160 | (I)实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响。 (II)实验①和③探究温度对该反应剧烈程度的影响。 (Ⅲ)实验①和④探究大理石规格对该反应剧烈程度的影响。 |
② | 210 | ||||
③ | 35 | 粗颗粒 | 18.25% | 60 | |
④ | 100 |
②_____________________________________
④_____________________________________
(4)实验结论:________________________________________________________。
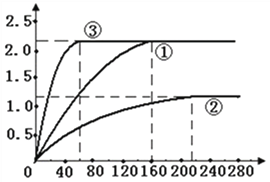
(5)绘制图像:实验①中CO2质量随时间变化的关系如右图,借助简单计算请在右图中画出实验②和③中CO2质量随时间变化关系的曲线(忽略溶液体积变化)。
 _____________________________________
_____________________________________
说明:(1)可以先用铅笔画曲线,然后用黑色签字笔描画。
(2)实验②中CaCO3过量,盐酸中HCl质量为1.825克全部参加反应;实验③中CaCO3过量,盐酸中HCl质量为3.65span>克全部参加反应.
【答案】 CaCO3+2HCl==== CaCl2+H2O+CO2↑ 25℃ 粗颗粒 9.125% 25℃ 细颗粒 18.25% 稀盐酸与大理石反应的剧烈程度与稀盐酸的质量分数,大理石规格,反应温度有关 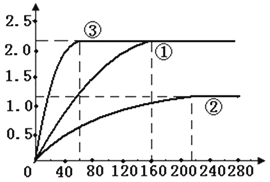
【解析】(1)实验室中用HCl与大理石反应的化学方程式为: ![]() ; (3)联系物理中学过的控制变量法,根据实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以实验②中的空缺应该分别是25、粗颗粒和9.125%。同理,实验④中的空缺应该分别是25、细颗粒和18.25%。即
; (3)联系物理中学过的控制变量法,根据实验①和②探究同体积下HCl质量分数对该反应剧烈程度的影响,就可以得出其温度和大理石规格应该是控制相同的;所以实验②中的空缺应该分别是25、粗颗粒和9.125%。同理,实验④中的空缺应该分别是25、细颗粒和18.25%。即
实验编号 | T/℃ | 大理石规格 | HCl的质量分数 |
② | 25 | 粗颗粒 | 9.125% |
④ | 25 | 细颗粒 | 18.25% |
(4)根据实验①和②探究时间(即160s和210s)可知,实验①比②用时少;这就说明了实验①比②反应剧烈。也就不难得出:在其他条件不变时,盐酸质量分数越大,反应越剧烈。同理可得,在其他条件不变时,温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈。所以,该实验结论应该是:在其他条件不变时,盐酸质量分数越大,反应越剧烈;温度越高,反应越剧烈;固体的颗粒越小,反应越剧烈。(5)根据实验①和②探究时所用的HCl质量分数(即9.125%和18.25%),可以得出同体积下实验②中的HCl是实验①中的![]() 。结合实验①中CO2质量随时间变化的关系图,可以推得:实验②的曲线中的纵坐标对应的每一个值均为实验①的
。结合实验①中CO2质量随时间变化的关系图,可以推得:实验②的曲线中的纵坐标对应的每一个值均为实验①的![]() 。再根据实验①和②探究时间(即160s和210s)可得,实验②的曲线中的纵坐标在210s时是直线。由于实验①和②探究温度对该反应剧烈程度的影响,并且实验得出升高温度,反应剧烈程度增大,但是产生二氧化碳的量不变,所以实验③的图象曲线低斜率变大。再根据实验①和③探究时间(即160s和60s)可得,实验③在60s时与实验①高度相同。即:
。再根据实验①和②探究时间(即160s和210s)可得,实验②的曲线中的纵坐标在210s时是直线。由于实验①和②探究温度对该反应剧烈程度的影响,并且实验得出升高温度,反应剧烈程度增大,但是产生二氧化碳的量不变,所以实验③的图象曲线低斜率变大。再根据实验①和③探究时间(即160s和60s)可得,实验③在60s时与实验①高度相同。即: