题目内容
电解水时,常在水中加入氢氧化钠使反应容易进行,氢氧化钠本身并不被分解.现用118g溶质质量分数为10%的氢氧化钠溶液进行电解水的实验,一段时间后,溶液中溶质质量分数变为11.8%,下列数据计算正确的是
- A.产生氧气质量为8g
- B.溶液中氢氧化钠质量为18g
- C.被电解的水的质量为18g
- D.反应后溶液质量为90g
C
分析:依据题意:氢氧化钠本身并不被分解,则其质量不变,据此计算反应后溶液的质量,及电解的水的质量,并可计算出生成的氧气的质量,并据溶质的质量=溶液的质量×溶质的质量分数计算溶液中氢氧化钠的质量;
解答:溶液中氢氧化钠的质量是:118g×10%=11.8g
设电解的水的质量为x.
118g×10%=(118g-x)×11.8%
得 x=18g
则反应后溶液的质量是118g-18g=100g
设产生氧气的质量为y
2H2O 2H2↑+O2↑
2H2↑+O2↑
36 32
18g y
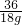 =
=
x=16g
综上分析可知:ABD错误
故选C.
点评:本题主要考查学生运用溶质的质量分数、化学方程式等进行计算的能力,须认真分析题意,并能根据质量分数公式计算,才能正确解答.
分析:依据题意:氢氧化钠本身并不被分解,则其质量不变,据此计算反应后溶液的质量,及电解的水的质量,并可计算出生成的氧气的质量,并据溶质的质量=溶液的质量×溶质的质量分数计算溶液中氢氧化钠的质量;
解答:溶液中氢氧化钠的质量是:118g×10%=11.8g
设电解的水的质量为x.
118g×10%=(118g-x)×11.8%
得 x=18g
则反应后溶液的质量是118g-18g=100g
设产生氧气的质量为y
2H2O
 2H2↑+O2↑
2H2↑+O2↑36 32
18g y
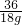 =
=
x=16g
综上分析可知:ABD错误
故选C.
点评:本题主要考查学生运用溶质的质量分数、化学方程式等进行计算的能力,须认真分析题意,并能根据质量分数公式计算,才能正确解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目