题目内容
(2008?石景山区一模)将一定量的 Na2CO3固体加足量的水溶解,配成59.2g 溶液.向其中逐渐滴加溶质质量分数为20%的稀盐酸,放出气体的质量与所滴入稀盐酸的质量关系如图1所示(反应后的溶液温度为20℃)请根据题意回答下列问题.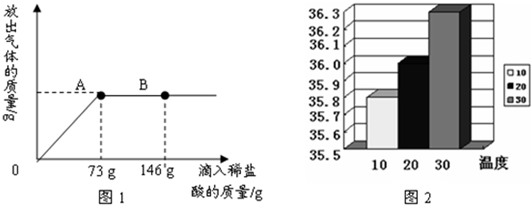
查阅相关资料:不同温度下氯化钠的溶解度(见图2)
(1)反应完全时,放出气体的总质量为
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是
(3)当滴加了73g稀盐酸时,通过计算说明烧杯中的溶液是否为饱和溶液.

查阅相关资料:不同温度下氯化钠的溶解度(见图2)
(1)反应完全时,放出气体的总质量为
4.4
4.4
g.(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是
NaCl和HCl
NaCl和HCl
.(3)当滴加了73g稀盐酸时,通过计算说明烧杯中的溶液是否为饱和溶液.
分析:(1)由题意可以知道滴加73g稀盐酸时是稀盐酸和碳酸钠恰好完全反应的时刻,可以据此结合稀盐酸的质量进行求解;
(2)从图中可以看出B点时稀盐酸过量,所以此时的溶液中的溶质为氯化钠和氯化氢,可以据此解答;
(3)根据(2)的分析可以知道A点为稀盐酸和碳酸钠恰好完全反应的时刻,所以可以据此计算出溶液中氯化钠的质量,结合氯化钠在该温度下的溶解度进行判断即可.
(2)从图中可以看出B点时稀盐酸过量,所以此时的溶液中的溶质为氯化钠和氯化氢,可以据此解答;
(3)根据(2)的分析可以知道A点为稀盐酸和碳酸钠恰好完全反应的时刻,所以可以据此计算出溶液中氯化钠的质量,结合氯化钠在该温度下的溶解度进行判断即可.
解答:解:(1)从图象可以看出当滴加盐酸的质量是73g时反应恰好完成,此时的气体质量即为气体的总质量;
设生成氯化钠的质量为x,生成二氧化碳的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 117 44
73g×10% x y
=
=
解得:x=11.7g y=4.4g
(2)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余.故溶液中的溶质为NaCl和HCl.
(3)根据(1)中的解答可以知道反应后溶液中溶质即氯化钠的质量为:11.7g;
溶液的总质量为59.2g+73g-4.4g=127.8g,假设溶液中的溶质能够全部溶解,则溶液中溶质的质量分数为
×100%=9.1%,20℃时氯化钠的溶解度为36g,故改饱和溶液的溶质质量分数为
×100%=26.5%,所以该温度下此时溶液不饱和.
故答案为:(1)4.4;(2)NaCl和HCl;(3)烧杯中的溶液是为该温度下的不饱和溶液;
设生成氯化钠的质量为x,生成二氧化碳的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 117 44
73g×10% x y
| 73 |
| 73g×10% |
| 117 |
| x |
| 44 |
| y |
解得:x=11.7g y=4.4g
(2)由图示可知,当滴加稀盐酸至图中A点时,已是完全反应,再滴加稀盐酸至图中B点时,盐酸就有剩余.故溶液中的溶质为NaCl和HCl.
(3)根据(1)中的解答可以知道反应后溶液中溶质即氯化钠的质量为:11.7g;
溶液的总质量为59.2g+73g-4.4g=127.8g,假设溶液中的溶质能够全部溶解,则溶液中溶质的质量分数为
| 11.7g |
| 127.8g |
| 36g |
| 100g+36g |
故答案为:(1)4.4;(2)NaCl和HCl;(3)烧杯中的溶液是为该温度下的不饱和溶液;
点评:本题较好的考查学生利用图象来分析化学反应的能力,学生应明确图象中的关键点及线的变化所表示的含义,将图象和化学反应紧密结合是解题的关键所在.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
 (2008?石景山区一模)归纳与反思是学习化学过程中的重要环节之一.下列几位同学对下图中蕴含知识的归纳不正确的是( )
(2008?石景山区一模)归纳与反思是学习化学过程中的重要环节之一.下列几位同学对下图中蕴含知识的归纳不正确的是( )