题目内容
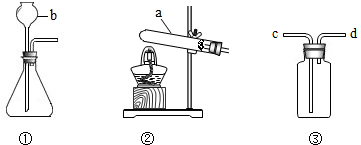
某金属冶炼厂从含有金属镁、铁、铜的废弃粉末中,分离和回收金属,设计如下实验方案:
请回答:
(1)步骤①中分离得到的金属B是 .
(2)步骤③中操作b的名称是 ;在此过程中需要使用玻璃棒,其作用是 .
(3)写出步骤②所涉及的化学反应方程式 .

请回答:
(1)步骤①中分离得到的金属B是
(2)步骤③中操作b的名称是
(3)写出步骤②所涉及的化学反应方程式
考点:金属的化学性质,蒸发与蒸馏操作,常见金属的特性及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)根据磁铁能吸引铁进行分析;
(2)根据操作b的实验目的以及实验过程的具体情况进行分析;
(3)根据步骤②的反应中反应物和生成物以及反应条件,依据质量守恒定律书写化学方程式;
(2)根据操作b的实验目的以及实验过程的具体情况进行分析;
(3)根据步骤②的反应中反应物和生成物以及反应条件,依据质量守恒定律书写化学方程式;
解答:解:(1)镁、铁、铜三种金属中只有铁能被磁铁吸引,所以步骤①中分离得到的金属B是:铁;
(2)氯化镁的溶液经过b操作后得到了氯化镁的固体,所以步骤③中操作b的名称是:蒸发,在此过程中需要使用玻璃棒,其作用是:蒸发时搅拌,使溶液均匀受热,防止溶液暴沸;
(3)A中加入一种溶液会得到一种金属和氯化镁的溶液,可知该溶液是盐酸,因铜的活动性在氢后所以不会与酸反应生成氢气,所以C是铜,步骤②的反应是镁和盐酸反应生成氯化镁和氢气,化学方程式为:Mg+2HCl=MgCl2+H2↑.
故答案为:(1)铁;
(2)蒸发,蒸发时搅拌,使溶液均匀受热,防止溶液暴沸;
(3)Mg+2HCl=MgCl2+H2↑.
(2)氯化镁的溶液经过b操作后得到了氯化镁的固体,所以步骤③中操作b的名称是:蒸发,在此过程中需要使用玻璃棒,其作用是:蒸发时搅拌,使溶液均匀受热,防止溶液暴沸;
(3)A中加入一种溶液会得到一种金属和氯化镁的溶液,可知该溶液是盐酸,因铜的活动性在氢后所以不会与酸反应生成氢气,所以C是铜,步骤②的反应是镁和盐酸反应生成氯化镁和氢气,化学方程式为:Mg+2HCl=MgCl2+H2↑.
故答案为:(1)铁;
(2)蒸发,蒸发时搅拌,使溶液均匀受热,防止溶液暴沸;
(3)Mg+2HCl=MgCl2+H2↑.
点评:此题是对金属性质的考查,解题的关键是对相关金属性质以及混合物分离的有关知识的掌握,属基础性知识考查题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
《舌尖上的中国》是一部大型美食类纪录片,很受观众欢迎.“美味健康”是人们对饮食的普遍追求,下列做法不可行的是( )
| A、在果汁中加入“塑化剂”使其口感更好 |
| B、在煲好的鸡汤中放入适当的加碘食盐 |
| C、在米粑中加入菠菜汁和红糖“添色加香” |
| D、炖鱼时加入生姜、辣椒来改善香味 |
在学习化学的过程中,我们会发现许多具有规律性的知识.下列叙述中不正确的是( )
| A、对难溶于水的气体可用排水集气法收集 |
| B、酸溶液中都含有相同的H+ |
| C、含碳元素的物质完全燃烧会产生二氧化碳 |
| D、金属都能与酸反应产生氢气 |
 燃料燃烧所产生的热量给生活与生产带来了很大的便利,但燃烧不当也会造成极大的损害.燃料不完全燃烧既浪费资源,产生的气体又对环境造成污染.为研究影响物质燃烧的因素,现设计如下图所示实验:将燃烧匙内小木炭块灼烧至红热后,立即伸入集气瓶内,并塞紧橡皮塞.将注射器内氧气迅速推入集气瓶内,观察到木炭发白光.该实验说明燃烧的剧烈程度与
燃料燃烧所产生的热量给生活与生产带来了很大的便利,但燃烧不当也会造成极大的损害.燃料不完全燃烧既浪费资源,产生的气体又对环境造成污染.为研究影响物质燃烧的因素,现设计如下图所示实验:将燃烧匙内小木炭块灼烧至红热后,立即伸入集气瓶内,并塞紧橡皮塞.将注射器内氧气迅速推入集气瓶内,观察到木炭发白光.该实验说明燃烧的剧烈程度与
 某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量稀盐酸后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.
某实验小组的同学用氢氧化钡溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钡溶液加入一定量稀盐酸后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.