题目内容
将20gH2、O2的混合气体点燃,完全反应后生成18g水,则原混合物中H2和O2的质量比可能是
- A.

- B.
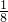
- C.
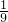
- D.

CD
分析:根据充分反应后生成18g水,利用化学反应方程式可知,2g氢气和16g氧气恰好完全反应生成18g水,则20g混合气体有剩余的气体存在,则有两种可能:①剩余气体为氢气;②剩余气体为氧气来分析解答.
解答:氢气和氧气反应的化学反应方程式为
2H2+O2 2H2O
2H2O
4 32 36
x y 18g
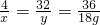 ,
,
解得x=2g,y=16g,
①若剩余气体为氢气,则氢气的质量为2g+(20g-18g)=4g,即混合气体中有4g氢气和16g氧气,两者质量比是 ,故D正确;
,故D正确;
②若剩余气体为氧气,则氧气的质量为16g+(20g-18g)=18g,即混合气体中有2g氢气和18g氧气,两者质量比是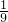 ,故C正确;
,故C正确;
故选CD.
点评:本题考查学生利用化学反应方程式的计算来分析混合物的成分,学生应能利用化学反应判断恰好完全反应的量,要注意过量计算过程的思维训练.
分析:根据充分反应后生成18g水,利用化学反应方程式可知,2g氢气和16g氧气恰好完全反应生成18g水,则20g混合气体有剩余的气体存在,则有两种可能:①剩余气体为氢气;②剩余气体为氧气来分析解答.
解答:氢气和氧气反应的化学反应方程式为
2H2+O2
 2H2O
2H2O4 32 36
x y 18g
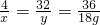 ,
,解得x=2g,y=16g,
①若剩余气体为氢气,则氢气的质量为2g+(20g-18g)=4g,即混合气体中有4g氢气和16g氧气,两者质量比是
 ,故D正确;
,故D正确;②若剩余气体为氧气,则氧气的质量为16g+(20g-18g)=18g,即混合气体中有2g氢气和18g氧气,两者质量比是
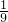 ,故C正确;
,故C正确;故选CD.
点评:本题考查学生利用化学反应方程式的计算来分析混合物的成分,学生应能利用化学反应判断恰好完全反应的量,要注意过量计算过程的思维训练.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目