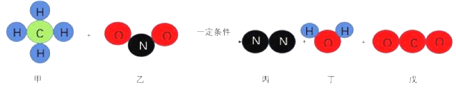
题目内容
【题目】科学探究是学习化学重要而有效的学习方法。某校化学兴趣小组的同学以酸为专题,对酸的五种化学性质进行探究、总结及应用,请回答有关问题:
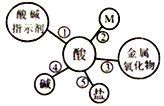
(1)酸的化学性质①一一酸与酸碱指示剂的作用。酸能使紫色石蕊溶液变成红色,不能使无色酚酞溶液变色。
(2)酸的化学性质②,图中M所代表的物质类别是_______。黄金是一种常见饰品,现实生活中,少数商贩用黄铜冒充黄金出售,可以用化学的方法加以鉴别。某同学为了测定黄铜(铜锌合金)样品的成分,将60g稀HCl分三次加入到盛有10g该样品的烧杯中,所得数据如下表,则该黄铜样品中含锌的质量分数为___________。
实验次数 物质质量 | 第1次 | 第2次 | 第3次 |
加入稀盐酸质量/ g | 20 | 20 | 20 |
充分反应后剩余固体质量/g | 8.7 | 7.4 | 6.4 |
(3)酸的化学性质③一一酸与金属氧化物的反应。盐酸可用于金属制品表面除锈等。
(4)酸的化学性质④一一酸碱中和反应。
该校化学兴趣小组的同学重点以“酸碱中和反应”为课题进行探究。小宇同学向烧杯中的氢氧化钠溶液中滴加稀硫酸,一会儿后发现忘了滴加酸碱指示剂,于是他停止滴加稀硫酸。同学们纷纷对实验烧杯溶液中含有哪些溶质展开了讨论。
[提出问题]实验的烧杯中溶质含有哪些物质?
[提出猜想]猜想一 :溶质中只有Na2SO4
猜想二:溶质中可能是Na2SO4和NaOH
猜想三:溶质中可能是____________________。
[查阅资料] Na2SO4溶液呈中性
[实验探究]小宇同学设计如下的实验方案
方法步骤 | 实验现象 | 实验结论 | |
方案一 | 取少量烧杯中的溶液于洁净的试管中, 滴入几滴无色酚酞溶液 | 酚酞不变红色 | 猜想一正确 猜想二不正确 |
方案二 | 取少量烧杯中的溶液于洁净的试管中, 滴加BaCl2溶液 | 出现白色沉淀 | 猜想三正确 |
方案三 | 取少量烧杯中的溶液于洁净的试管中,入少量的黑色CuO粉末,振荡 | _________ | 猜想三正确 |
[方案评价]同学们对小宇上述的方案讨论后认为:
①方案一存在缺陷,该方案不能证明猜想一是正确的,其原因是____________________。
②方案二也不能证明猜想三是正确的,理由是__________________________________。
③同学们经过讨论,一致认为方案三能够证明猜想三是正确的,并讨论除此方案外,还可以向烧杯的溶液中加入活泼金属、碳酸盐等物质进行证明。
[实验反思]在分析化学反应后所得物质成分时,还需考虑反应物的用量。
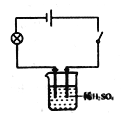
[学科渗透]如图所示,小宇同学在进行溶液导电性的实验时,将电极两端插入稀H2SO4溶液中,闭合开关,小灯泡正常发光,然后逐滴向稀H2SO4中加入Ba(OH)2溶液至过量,请推测小灯泡的发光情况为__________________;发生反应的化学方程式是___________。
(5)酸的化学性质⑤一一酸与盐的反应
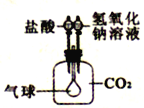
利用下图所示装置来验证CO2气体的性质,要证明CO2与NaOH溶液能够发生反应,可先加氢氧化钠溶液,再加盐酸,气球的变化是_____________。
[方法感悟]在化学实验中,可通过验证反应后生成物的存在,来验证某化学反应的发生。
【答案】 金属或金属单质 36% 硫酸钠和硫酸(或Na2SO4、H2SO4) 黑色固体逐渐溶解,溶液由无色变为蓝色 溶液中含有H2SO4也不能使无色酚酞溶液变红(或酸性溶液和中性溶液都不能使无色酚酞溶液变红) Na2SO4也能与BaCl2反应产生白色沉淀,无法判断是否含有H2SO4 小灯泡逐渐变暗至熄灭,再逐新变亮 H2SO4+Ba(OH)2=BaSO4↓+2H2O 先胀大,后变瘪或先变大再变小直到恢复原状
【解析】本题考查了酸的通性,碱、盐的化学性质,难度不大,首先分析考查的问题,然后结合题中的现象和学过的知识进行分析解答。
(1)酸的通性是酸能与酸碱指示剂、金属、金属氧化物、碱和某些盐发生反应,所以M是金属或金属单质;
(2)第一次加入20g盐酸减少的固体即反应的锌的质量为10g-8.7g=1.3g,第二次加入20g盐酸减少的固体即反应的锌的质量为8.7g-7.4g=1.3g,第三次减少的固体为7.4g-6.4g=1.0g,此时锌反应完全,稀盐酸有剩余。剩余的固体为铜,黄铜中锌的质量=10g-6.4g=3.6g,黄铜样品中含锌的质量分数=![]() ×100%=36%;
×100%=36%;
(4)提出猜想:氢氧化钠和硫酸反应生成了硫酸钠和水,恰好完全反应时,烧杯中溶质是硫酸钠,氢氧化钠过量时,烧杯中溶质是硫酸钠和氢氧化钠,硫酸过量时,烧杯中溶质是硫酸钠和硫酸,所以猜想三中溶质中可能是硫酸钠和硫酸(或Na2SO4、H2SO4);
实验探究:若猜想三正确,溶质中是硫酸钠和硫酸,硫酸与氧化铜反应生成硫酸铜和水,所以取少量烧杯中的溶液于洁净的试管中,加入少量的黑色CuO粉末,振荡,黑色固体逐渐溶解,溶液由无色变为蓝色;
方案评价:①溶液中含有H2SO4也不能使无色酚酞溶液变红(或酸性溶液和中性溶液都不能使无色酚酞溶液变红) 所以方案一存在缺陷,该方案不能证明猜想一是正确;
②,溶液中一定存在Na2SO4,Na2SO4也能与BaCl2反应产生白色沉淀,无法判断是否含有H2SO4,所以方案二也不能证明猜想三是正确;
学科渗透:氢氧化钡溶液中存在着大量的能够自由移动的钡离子与氢氧根离子,氢氧化钡溶液能够导电;将稀硫酸滴加到氢氧化钡溶液中时,能够观察到产生白色沉淀,随着反应的进行溶液中能够自由移动的离子数目的减少,溶液的导电性减弱,灯泡由亮变暗,当恰好完全反应时,灯泡几乎熄灭,继续滴加稀硫酸,溶液中能够自由移动的离子数目增多,溶液的导电性增强,灯泡又慢慢变亮,所以推测小灯泡的发光情况为小灯泡逐渐变暗至熄灭,再逐新变亮,该反应的化学方程式为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(5) 二氧化碳被氢氧化钠溶液吸收生成碳酸钠和水,瓶内压强变小,气球变大;再滴加盐酸,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,瓶内压强变大,气球变小,所以先加氢氧化钠溶液,再加盐酸,气球的变化是先胀大,后变瘪或先变大再变小直到恢复原状。