题目内容
分离、除杂提纯和检验是化学实验的重要环节.下面实验设计能够达到目的是( )
| 实验内容 | 实验设计 | |
| A | 除去粗盐中的沙子 | 溶解、过滤 |
| B | 提纯久置变质的氢氧化钠溶液 | 先加入足量氯化钙溶液,充分反应后,过滤 |
| C | 验证某溶液为稀盐酸 | 先测溶液的pH<7,再加入锌粒 |
| D | 分离二氧化碳和一氧化碳混合物 | 先用氢氧化钠溶液吸收掉二氧化碳分离出一氧化碳,再向该氢氧化钠溶液加足量稀盐酸“释放”出二氧化碳 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案设计与评价,常见气体的检验与除杂方法,酸的化学性质,碱的化学性质,氯化钠与粗盐提纯
专题:简单实验方案的设计与评价
分析:A、根据除去粗盐中的沙子的操作步骤分析进行解答;
B、根据久置变质的氢氧化钠溶液可能含有碳酸钠,所以加入足量氯化钙溶液会生成碳酸钙沉淀和氯化钠,氯化钠是新的杂质进行解答;
C、根据溶液的pH<7,再加入锌粒有气泡冒出不一定是盐酸,还有可能是别的酸进行解答;
D、根据一氧化碳不和氢氧化钠溶液反应,而二氧化碳和氢氧化钠钠溶液反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行解答.
B、根据久置变质的氢氧化钠溶液可能含有碳酸钠,所以加入足量氯化钙溶液会生成碳酸钙沉淀和氯化钠,氯化钠是新的杂质进行解答;
C、根据溶液的pH<7,再加入锌粒有气泡冒出不一定是盐酸,还有可能是别的酸进行解答;
D、根据一氧化碳不和氢氧化钠溶液反应,而二氧化碳和氢氧化钠钠溶液反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳进行解答.
解答:解:A、除去粗盐中的沙子,采用溶解、过滤、蒸发的方法得到精盐,故A错误;
B、久置变质的氢氧化钠溶液可能含有碳酸钠,所以加入足量氯化钙溶液会生成碳酸钙沉淀和氯化钠,氯化钠是新的杂质,故B错误;
C、溶液的pH<7,再加入锌粒有气泡冒出不一定是盐酸,还有可能是别的酸,例如稀硫酸,故C错误;
D、一氧化碳不和氢氧化钠溶液反应,而二氧化碳和氢氧化钠钠溶液反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以分离二氧化碳和一氧化碳混合物可用氢氧化钠溶液吸收掉二氧化碳分离出一氧化碳,再向该氢氧化钠溶液加足量稀盐酸“释放”出二氧化碳,故D正确.
故选:D.
B、久置变质的氢氧化钠溶液可能含有碳酸钠,所以加入足量氯化钙溶液会生成碳酸钙沉淀和氯化钠,氯化钠是新的杂质,故B错误;
C、溶液的pH<7,再加入锌粒有气泡冒出不一定是盐酸,还有可能是别的酸,例如稀硫酸,故C错误;
D、一氧化碳不和氢氧化钠溶液反应,而二氧化碳和氢氧化钠钠溶液反应生成碳酸钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以分离二氧化碳和一氧化碳混合物可用氢氧化钠溶液吸收掉二氧化碳分离出一氧化碳,再向该氢氧化钠溶液加足量稀盐酸“释放”出二氧化碳,故D正确.
故选:D.
点评:解答本题的关键是要充分理解各种物质的性质,只有这样才能对问题做出正确的判断,另外需要注意的就是选用的除杂试剂不能与原有物质反应,反应后不能引入新的杂质,还需要根据实际情况控制所选试剂的量.

练习册系列答案
相关题目
下列家庭小实验,不能成功的是( )
| A、用肥皂水鉴别硬水和软水 | B、用食盐水除去热水瓶中的水垢 | C、用冷碟子放在蜡烛火焰上方制炭黑 | D、用酒精浸泡捣烂的某些植物的花瓣可制酸碱指示剂 |
下列实验方案设计不合理的是( )
| A、用盐酸来区分石灰石与熟石灰 | B、用燃着的木条区分二氧化碳和氮气 | C、用磁铁吸引来区分铁丝和铝丝 | D、用水区分氢氧化钠固体和硝酸铵固体 |
下列仪器不能用酒精灯直接加热的是( )
| A、试管 | B、量筒 | C、燃烧匙 | D、蒸发皿 |
如图所示的实验操作中正确的是( )
A、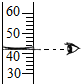 量取液体 | B、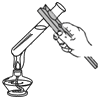 加热液体 | C、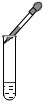 滴加液体 | D、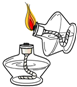 点酒精灯 |
如图所示的实验操作中,正确的是( )
A、 读取液体 | B、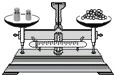 称量固体 | C、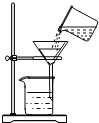 过滤 | D、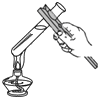 给试管中的液体加热 |
下列实验操作正确的是( )
A、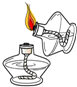 点燃酒精灯 | B、 闻气体气味 | C、 移开蒸发皿 | D、 加热液体 |