题目内容
下表为某同学探究铜、锌、铁、镁四种金属活动性顺序,所做的金属与稀盐酸的反应一组实验:
请你参加下列讨论:
(1)请将铜、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置.
(2)写出锌与稀盐酸反应的化学方程式:
(3)家用铝锅、铁锅不能用来长时间盛放酸性食品理由是:
(4)还能通过其它实验证明铁、铜二种金属的金属活动性顺序.请你补充一个实验帮助这位同学达到实验目的.
| 金属 | 铜 | 锌 | 铁 | 镁 |
| 实验现象 | 没有气体产生 | 有气体产生 反应剧烈 |
有气体产生 反应缓慢 |
有气体产生 反应迅速 |
(1)请将铜、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置.

(2)写出锌与稀盐酸反应的化学方程式:
Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
,其反应属于置换
置换
(填“置换”或“分解”)反应.(3)家用铝锅、铁锅不能用来长时间盛放酸性食品理由是:
铁与铝都能和酸反应
铁与铝都能和酸反应
.(4)还能通过其它实验证明铁、铜二种金属的金属活动性顺序.请你补充一个实验帮助这位同学达到实验目的.
| 实验步骤 | 现象 | 结论和化学方程式 |
分析:(1)根据金属的活动性顺序的应用来进行解答;
(2)锌和稀盐酸反应生成了氯化锌和氢气,该反应为置换反应,可以据此解答;
(3)根据铁和铝的金属活动性顺序来进行解答即可;
(4)证明铁和铜的活动性顺序只要选择两种金属中的任一种金属和另一种金属的溶液即可完成判断.
(2)锌和稀盐酸反应生成了氯化锌和氢气,该反应为置换反应,可以据此解答;
(3)根据铁和铝的金属活动性顺序来进行解答即可;
(4)证明铁和铜的活动性顺序只要选择两种金属中的任一种金属和另一种金属的溶液即可完成判断.
解答:解:(1)金属与酸接触时,反应越剧烈,活动性越强,所以可以判断活动性最强的为镁,其次是锌,再次是铁,而铜不能和酸反应,所以其在金属活动性顺序中位于氢的后边;
(2)锌和稀盐酸反应生成了氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑该反应为置换反应;
(3)铁与铝都能和酸反应,所以家用铝锅、铁锅不能用来长时间盛放酸性食品;
(4)证明铁和铜的活动性顺序只要选择两种金属中的任一种金属和另一种金属的溶液,所以在这里我们可以选择铁和硫酸铜溶液,将铁丝才伸入硫酸铜溶液中,观察到铁的表面有红色的物质生成,则可以判断金属铁的活动性顺序比铜强.
故答案为:(1)镁;锌;铁;铜;
(2)Zn+2HCl═ZnCl2+H2↑;置换;
(3)铁与铝都能和酸反应;
(4)
(2)锌和稀盐酸反应生成了氯化锌和氢气,反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑该反应为置换反应;
(3)铁与铝都能和酸反应,所以家用铝锅、铁锅不能用来长时间盛放酸性食品;
(4)证明铁和铜的活动性顺序只要选择两种金属中的任一种金属和另一种金属的溶液,所以在这里我们可以选择铁和硫酸铜溶液,将铁丝才伸入硫酸铜溶液中,观察到铁的表面有红色的物质生成,则可以判断金属铁的活动性顺序比铜强.
故答案为:(1)镁;锌;铁;铜;
(2)Zn+2HCl═ZnCl2+H2↑;置换;
(3)铁与铝都能和酸反应;
(4)
| 实验步骤 | 现象 | 结论和化学方程式 |
| 将铁丝才伸入硫酸铜溶液中 | 铁的表面有红色的物质生成 | 铁的金属活动性顺序比铜强 Fe+CuSO4 ═FeSO4+Cu |
点评:实验方案设计要考虑各种可行性方案,然后在方案中寻找最佳的方案付诸实施.不同的方案的原理也不尽相同,所以要勤思考,多总结.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
某同学收集生活中的物质(见下表),建立了家庭小实验室.请你参与下面的探究.
(1)下表是该同学对这些物质分类存放的情况,请你在表中填写物质类别.(选填“金属”、“氧化物”、“酸”、“碱”、“盐”、“有机物”)
(2)食盐是由 构成的,铜是由 构成的,蔗糖是由 构成的.(选填“分子”、“原子”、或“离子”)
(3)请你仅利用表中的物质及水制取氢氧化钠溶液,写出反应的化学方程式: .请你仅利用表中的物质作反应物,另写一个反应的化学方程式: .
(4)请你自制指示剂并测定纯碱溶液的酸碱性,完成下面的实验报告:
(5)该同学粗略测定家里所用白醋中醋酸的质量分数(假设白醋中的酸都看作醋酸,醋酸的化学式为CH3COOH),在玻璃杯中加入10.0g碳酸钙粉末,再倒入200.0g白醋.反应停止后,碳酸钙有剩余,称得玻璃杯中的固体和液体总质量为207.8g.醋酸与碳酸钙反应的化学方程式为:2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O若不考虑醋酸与水的挥发及二氧化碳的溶解,求:
①反应生成的二氧化碳质量为 g.
②所测白醋中CH3COOH的质量分数.(写出计算过程)(相对分子质量:H-1,C-12,O-16,Ca-40)
(1)下表是该同学对这些物质分类存放的情况,请你在表中填写物质类别.(选填“金属”、“氧化物”、“酸”、“碱”、“盐”、“有机物”)
| 物质类别 | |||||
| 物质 | 蔗糖、酒精 | 铜丝、铁丝 | 盐酸 | 熟石灰 | 高锰酸钾、食盐、纯碱 |
(3)请你仅利用表中的物质及水制取氢氧化钠溶液,写出反应的化学方程式:
(4)请你自制指示剂并测定纯碱溶液的酸碱性,完成下面的实验报告:
| 实验步骤 | 实验现象 | 结论 |
| ①将切碎的紫包菜放入玻璃杯中,加入 |
自制指示剂呈紫色 | \ |
| ②分别向盛有少量澄清石灰水、盐酸的玻璃杯中加入几滴自制指示剂 | 自制指示剂遇石灰水变蓝色,遇盐酸变红色 | 能使自制指示剂变蓝色的溶液显 |
| ③取少量纯碱放入玻璃杯中,加水搅拌溶解.向其中加加几滴自制指示剂 | 自制指示剂变 |
纯碱溶液显碱性 |
①反应生成的二氧化碳质量为
②所测白醋中CH3COOH的质量分数.(写出计算过程)(相对分子质量:H-1,C-12,O-16,Ca-40)
下表为某同学探究铜、锌、铁、镁四种金属活动性顺序,所做的金属与稀盐酸的反应一组实验:
请你参加下列讨论:
(1)请将铜、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置.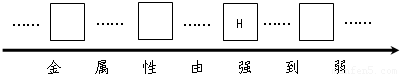
(2)写出锌与稀盐酸反应的化学方程式:______,其反应属于______(填“置换”或“分解”)反应.
(3)家用铝锅、铁锅不能用来长时间盛放酸性食品理由是:______.
(4)还能通过其它实验证明铁、铜二种金属的金属活动性顺序.请你补充一个实验帮助这位同学达到实验目的.
| 金属 | 铜 | 锌 | 铁 | 镁 |
| 实验现象 | 没有气体产生 | 有气体产生 反应剧烈 | 有气体产生 反应缓慢 | 有气体产生 反应迅速 |
(1)请将铜、镁、铁三种金属的元素符号填写在下列金属活动性顺序表中的相应位置.

(2)写出锌与稀盐酸反应的化学方程式:______,其反应属于______(填“置换”或“分解”)反应.
(3)家用铝锅、铁锅不能用来长时间盛放酸性食品理由是:______.
(4)还能通过其它实验证明铁、铜二种金属的金属活动性顺序.请你补充一个实验帮助这位同学达到实验目的.
| 实验步骤 | 现象 | 结论和化学方程式 |
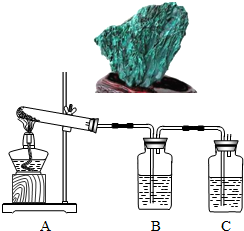 (2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.
(2012?大兴区二模)孔雀石主要成分是碱式碳酸铜[Cu2(OH)2CO3],绿色并具有浓淡的条状花纹(见右图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.某校课外小组同学欲在实验室验证碱式碳酸铜制铜的反应原理.