题目内容
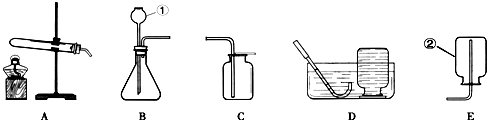
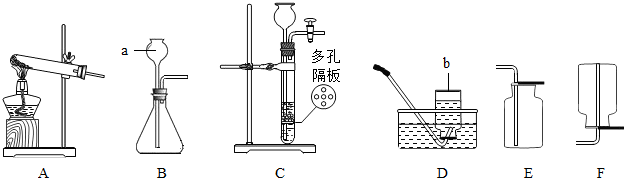
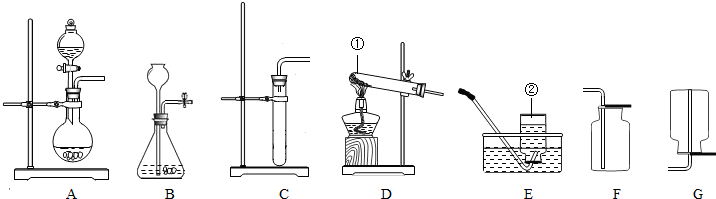
如图是实验室制取气体的一些装置.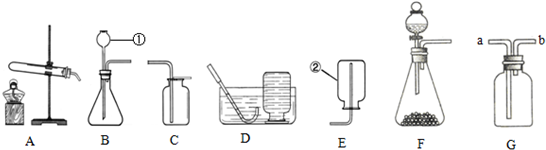
(1)写出带标号的仪器的名称:①
(2)实验室若用氯酸钾为原料来制取氧气,应选择的装置组合是
(3)检查装置B的气密性的方法是
(4)若用G装置收集氢气,则导管应与G的
(5)乙炔(化学式为C2H2)又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石固体(主要成分CaC2)与水反应制取乙炔,已知反应过程中还生成了另一种化合物.请你选择制取乙炔的发生装置是

(1)写出带标号的仪器的名称:①
长颈漏斗
长颈漏斗
;②集气瓶
集气瓶
.(2)实验室若用氯酸钾为原料来制取氧气,应选择的装置组合是
AC(或D)
AC(或D)
(填装置编号,下同);制取过程一般还选用二氧化锰作反应的催化剂
催化剂
.发生反应的化学方程式为2KClO3
2KCl+3O2 ↑
| ||
| △ |
2KClO3
2KCl+3O2 ↑
.
| ||
| △ |
(3)检查装置B的气密性的方法是
关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好.
关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好.
.(4)若用G装置收集氢气,则导管应与G的
b
b
(填“a”或“b”)端相连.(5)乙炔(化学式为C2H2)又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石固体(主要成分CaC2)与水反应制取乙炔,已知反应过程中还生成了另一种化合物.请你选择制取乙炔的发生装置是
B
B
;收集装置是D
D
.写出实验室制取乙炔的化学方程式CaC2+2H2O=C2H2↑+Ca(OH)2
CaC2+2H2O=C2H2↑+Ca(OH)2
.分析:(1)直接写仪器名称;
(2)根据氯酸钾分解制氧气的原理、装置分析
(3)根据装置气密性检查的方法分析
(4)根据氢气的密度分析
(5)根据发生装置和收集装置选择依据分析
(2)根据氯酸钾分解制氧气的原理、装置分析
(3)根据装置气密性检查的方法分析
(4)根据氢气的密度分析
(5)根据发生装置和收集装置选择依据分析
解答:解:(1)仪器的名称为:①长颈漏斗;②集气瓶.
(2)氯酸钾是固体,反应条件是加热,发生装置应选A,氧气不易溶于水,可用排水法收集,密度比空气大,可用向上排空气法收集,故应选择的装置组合是A、C(或D);单独加热氯酸钾反应速度太慢,因此加入二氧化锰作反应的 催化剂.反应的化学方程式为 2KClO3
2KCl+3O2 ↑
.
(3)检查装置B的气密性的方法是 关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好..
(4)氢气密度比空气小,气体应从b管进,将空气从a管排出.
(5)电石是固体,水是液体,发生装置选择B,乙炔密度比空气略小,不能用排空气法收集,不溶于水,可用排水法收集.故收集装置选择D;电石与水反应生成乙炔和氢氧化钙,化学方程式为CaC2+2H2O=C2H2↑+Ca(OH)2
故答案为:(1)①长颈漏斗;②集气瓶.
(2)AC或AD 催化剂. 2KClO3
2KCl+3O2 ↑.
(3)关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好..
(4)b
(5)B; D. CaC2+2H2O=C2H2↑+Ca(OH)2
(2)氯酸钾是固体,反应条件是加热,发生装置应选A,氧气不易溶于水,可用排水法收集,密度比空气大,可用向上排空气法收集,故应选择的装置组合是A、C(或D);单独加热氯酸钾反应速度太慢,因此加入二氧化锰作反应的 催化剂.反应的化学方程式为 2KClO3
| ||
| △ |
.
(3)检查装置B的气密性的方法是 关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好..
(4)氢气密度比空气小,气体应从b管进,将空气从a管排出.
(5)电石是固体,水是液体,发生装置选择B,乙炔密度比空气略小,不能用排空气法收集,不溶于水,可用排水法收集.故收集装置选择D;电石与水反应生成乙炔和氢氧化钙,化学方程式为CaC2+2H2O=C2H2↑+Ca(OH)2
故答案为:(1)①长颈漏斗;②集气瓶.
(2)AC或AD 催化剂. 2KClO3
| ||
| △ |
(3)关闭止水夹,从长颈漏斗内加水至漏斗内有水,看液面是否下降,若不下降,则气密性良好..
(4)b
(5)B; D. CaC2+2H2O=C2H2↑+Ca(OH)2
点评:了解气体制取装置的选择和连接方法;掌握氧气的制取装置、原理和检验方法;能够根据所给物质的性质来选择发生和收集装置

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目