题目内容
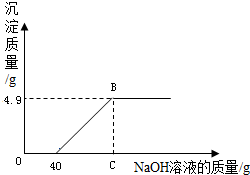 (2011?营口) 现有硫酸和硫酸铜的混合溶液124.9g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀的质量与所加入的氢氧化钠溶液的质量关系如右图所示.求:
(2011?营口) 现有硫酸和硫酸铜的混合溶液124.9g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀的质量与所加入的氢氧化钠溶液的质量关系如右图所示.求:(1)恰好生成最大沉淀量时所加入的氢氧化钠溶液的总质量为________g;
(2)恰好生成最大沉淀量时所得溶液中溶质的质量分数.
分析:(1)由关系图,向混合溶液中滴加氢氧化钠溶液先与硫酸反应,待混合溶液中硫酸完全反应后开始与硫酸铜溶液发生反应,因此在计算生成最大沉淀量时所加入的氢氧化钠溶液的总质量时,应该考虑到上述的反应情况,即所加入的氢氧化钠溶液的总质量为与硫酸反应的溶液和与硫酸铜反应的溶液质量和.
(2)分析题意可知,反应至C点时溶液中溶质为硫酸钠,根据氢氧化钠与硫酸酸反应的化学方程式,列出比例式,计算出生成硫酸钠的质量,然后根据“溶质质量分数=
×100%”计算即可.
(2)分析题意可知,反应至C点时溶液中溶质为硫酸钠,根据氢氧化钠与硫酸酸反应的化学方程式,列出比例式,计算出生成硫酸钠的质量,然后根据“溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)设与硫酸铜反应的NaOH溶液的质量为x
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 142 98
10%x y 4.9g
=
=
x=40g
y=7.1g
∴生成最大沉淀量时所加入的氢氧化钠溶液的总质量为:40g+40g=80g
(2)设40g氢氧化钠与硫酸反应生成的硫酸钠的质量为z
2NaOH+H2SO4═Na2SO4+2H2O
80 142
40×10%g z
=
z=7.1g
所得硫酸钠溶液溶质的质量分数为
×100%=7.1%
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为80g;
恰好生成最大沉淀量时所得溶液中溶质的质量分数7.1%
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
80 142 98
10%x y 4.9g
| 80 |
| 98 |
| 10%x |
| 4.9g |
| 142 |
| 98 |
| y |
| 4.9g |
x=40g
y=7.1g
∴生成最大沉淀量时所加入的氢氧化钠溶液的总质量为:40g+40g=80g
(2)设40g氢氧化钠与硫酸反应生成的硫酸钠的质量为z
2NaOH+H2SO4═Na2SO4+2H2O
80 142
40×10%g z
| 80 |
| 142 |
| 40×10%g |
| z |
z=7.1g
所得硫酸钠溶液溶质的质量分数为
| 7.1g+7.1g |
| 124.9g+40g+40g-4.9g |
答:生成最大沉淀量时所加入的氢氧化钠溶液的总质量为80g;
恰好生成最大沉淀量时所得溶液中溶质的质量分数7.1%
点评:数形结合类问题,在分析时反应的关系图的分析为正确判断反应进行的依据和基础.弄清折点的含义,是解决此题的关键之所在.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目