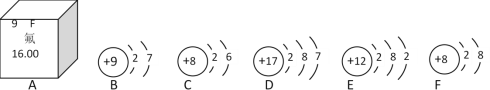
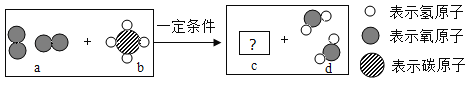
题目内容
【题目】己知铜、氧元素组成某固体样品,可能由CuO、Cu2O、Cu其中一种或多种组成,取14.4克固体样品与足量的H2充分反应后,测得生成水的质量为1.8克,则关于该固体样品的组成说法正确的是:(提示:H2+CuO![]() Cu+H2O;H2+Cu2O
Cu+H2O;H2+Cu2O![]() 2Cu+H2O )
2Cu+H2O )
A. 该样品可能是纯净的Cu2O
B. 若该样品含多种物质,则样品中一定含Cu2O
C. 若该样品含多种物质,则样品中一定含Cu和CuO
D. 该样品中一定含有3种物质
【答案】AC
【解析】
根据氧元素质量守恒,固体混合物中氧元素的质量等于水中氧元素的质量,再求出铁和氧的原子个数比,结合选项进行分析解答。
1.8g水中氧元素的质量=1.8g![]()
![]() =1.6g,则固体混合物中铜元素的质量=12.8g,所以固体混合物中铜和氧的原子个数比=
=1.6g,则固体混合物中铜元素的质量=12.8g,所以固体混合物中铜和氧的原子个数比=![]() :
:![]() =2:1;A、Cu2O中铜和氧的原子个数比=2:1,故A正确;B、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故B错误;C、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故C正确;D、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故D错误。故选AC。
=2:1;A、Cu2O中铜和氧的原子个数比=2:1,故A正确;B、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故B错误;C、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故C正确;D、若含有多种物质,Cu2O中铜和氧的原子个数比=2:1,也可以是CuO和Cu的组合,其中铜和氧的原子个数比=2:1,故D错误。故选AC。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:其他同学认为不必查阅氯化镁的颜色,理由是______;
物 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
色 | 白 | 白 | 淡黄 | 白 | 白 | 白 |
[提出问题]为什么会生成淡黄色固体?
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的氮气反应生成的,镁条在空气中燃烧的化学方程式为:__________、___________
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能____________
拓展:空气中氮气含量远大于氧气含量,但生成的淡黄色固体却比较少,原因是________。