题目内容
某同学为了测定一瓶稀盐酸的浓度,取100g该盐酸放入烧杯中,然后在该烧杯中加入10g铁粉样品(杂质即不参加反应也不溶于水),恰好完全反应;此时称量烧杯中剩余物的质量为109.8g.
求:
①生成氢气的质量;
②该盐酸中溶质的质量分数.
解:(1)根据质量守恒定律,可得生成氢气的质量为:100g+10g-109.8g=0.2g;
(2)设盐酸中溶质的质量分数为x
Fe+2HCl=FeCl2+H2↑
73 2
100g×x 0.2g
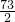 =
=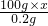 解得 x=7.3%
解得 x=7.3%
答:①生成氢气的质量为0.2g;
②该盐酸中溶质的质量分数7.3%.
分析:(1)根据质量守恒定律,生成氢气的质量为反应前的总质量与反应后总质量的差;
(2)根据反应方程式,利用生成氢气的质量,列出比利式计算即可解答.
点评:本题考查学生根据质量守恒定律与化学方程式进行分析解题的能力.
(2)设盐酸中溶质的质量分数为x
Fe+2HCl=FeCl2+H2↑
73 2
100g×x 0.2g
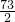 =
=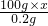 解得 x=7.3%
解得 x=7.3% 答:①生成氢气的质量为0.2g;
②该盐酸中溶质的质量分数7.3%.
分析:(1)根据质量守恒定律,生成氢气的质量为反应前的总质量与反应后总质量的差;
(2)根据反应方程式,利用生成氢气的质量,列出比利式计算即可解答.
点评:本题考查学生根据质量守恒定律与化学方程式进行分析解题的能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目