题目内容
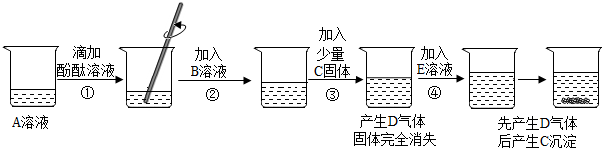
实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的所用物质均是初中化学常见的,且每一步均有明显现象,实验操作及部分现象如下图所示。

回答下列问题:
(1)A溶液一定呈 性(填“酸”或“中”或“碱”)。
(2)气体D的化学式为 。
(3)步骤②的实验现象为 。
(4)E溶液中的溶质可能是 。
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为 。
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为酚酞和 。
(1)碱 (2)CO2 (3)红色液体变为无色 (4)Na2CO3
(5)Na2CO3+2HCl ==2NaCl+H2O+CO2↑ (6)NaCl 、CaCl2
【解析】
试题分析:(1)根据题意,“每一步均有明显现象”可知,A溶液滴加酚酞后应变红,而只有碱遇到酚酞会变红,故A溶液一定呈碱性;
(2)根据图示,加入C固体后会产生D气体,而再加入E溶液后,又会先产生D气体后产生C沉淀,结合所学知识,酸能和碳酸盐反应放出二氧化碳气体,而若酸剩余,再加入某碳酸盐,会继续反应产生二氧化碳气体,当酸反应完全后,剩余物质会与该碳酸盐继续反应,生成碳酸盐沉淀,符合题意,故气体D的化学式为CO2;
(3)由于“每一步均有明显现象”,故加入B溶液后,红色应退去;
(4)碳酸钠能和酸反应生成二氧化碳,能和可溶性钙盐反应生成碳酸钙沉淀,故E溶液中的溶质可能是Na2CO3;
(5)根据上面的分析可知,B溶液应为酸,又知B溶液的溶质由两种元素组成,故为盐酸;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故④中产生气体的反应的化学方程式为Na2CO3+2HCl =2NaCl+H2O+CO2↑;
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,说明溶液中仍有氯化钙存在;另外,由于反应中同时还生成了氯化钠,所以实验后所得溶液含有的溶质为NaCl、CaCl2和酚酞。
考点:物质的鉴别、推断,酸碱指示剂及其性质,盐的化学性质,书写化学方程式
点评:在解此类题时,先要找准“题眼”,即有特征的物质或反应现象等,再根据题中的条件进行有目的假设,然后沿着假设进行推导,只要各步都满足,假设就成立,如不满足,可再假设,再验证。

 ,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示。
,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示。
 。
。 程式为 。
程式为 。