题目内容
【题目】我国海岸线曲折,海洋资源十分丰富
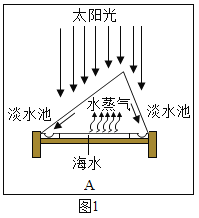
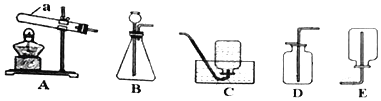
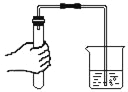
(1)如图1所示,从海水中获得淡水的方法是______。你认为该技的优点是______。
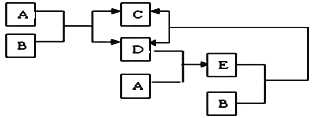
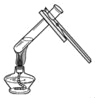
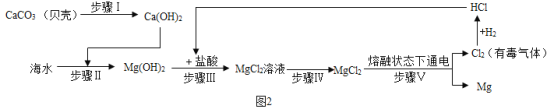
(2)从海水中提取金属镁,可按如图2所示流程进行。
反应①中加入石灰乳的量应是______,反应②中发生了中和反应,试剂1为______(填名称),该反应的化学方程式为______;操作2中玻璃棒的作用是______;写出反应④的化学方程式______,反应基本类型为______。
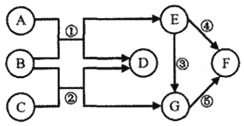
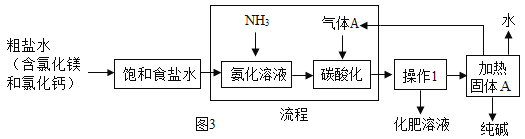
(3)我国著名化学家侯德榜发明的联合制碱法”主要工艺流程示意图如图3:
①流程一,氨化溶液后,溶液的pH______7(选填“>”、“<”或“=”),从而有利于吸收气体A,流程一反应的化学方程式为______。
②有人认为“侯氏制碱法”有以下优点,你认为正确的是______。
A.生产过程中部分产物可作为原料使用
B.副产品是一种氮肥
C.反应不需要加热,可节约能源
【答案】蒸馏法 节约能源、减少成本 过量 稀盐酸 Mg(OH)2+2HCl=MgCl2+2H2O 搅拌 MgCl2![]() Mg+Cl2↑ 分解反应 > NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl ABC
Mg+Cl2↑ 分解反应 > NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl ABC
【解析】
(1)如图Ⅰ所示,从海水中获得淡水的方法是蒸馏法,使用该技术的优点是节约能源、减少成本;
(2)反应①中加入过量的氢氧化钙可以使氯化镁完全反应,氢氧化镁和盐酸反应生成氯化镁和水,所以试剂1为稀盐酸,该反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,操作2中玻璃棒的作用是搅拌,反应④是氯化镁在通电的条件下生成镁和氯气,化学方程式为:MgCl2![]() Mg+Cl2↑,该反应属于分解反应;
Mg+Cl2↑,该反应属于分解反应;
(3)①氨气溶于水形成氨水,氨水显碱性,所以溶液的pH>7,氨气、水、氯化钠和二氧化碳反应生成碳酸氢钠沉淀和氯化铵,化学方程式为:NH3+NaCl+H2O+CO2=NaHCO3↓+NH4Cl;
②A、碳酸氢钠加热生成的二氧化碳可以循环使用,所以生产过程中部分产物可作为原料使用,故正确;
B、副产品氯化铵是一种氮肥,故正确;
C、反应不需要加热,可节约能源,故正确。