题目内容
【题目】某固体粉末为氧化铜和铜的混合物,某同学取8克混合物,将40克稀硫酸分4次加入,所得数据如表所示:
序号 | 一 | 二 | 三 | 四 |
加入稀硫酸质量(克) | 10 | 10 | 10 | 10 |
剩余固体质量(克) | 6 | X | 3 | 3 |
请分析数据,回答下列问题:
(1)上表中,X的值为_____,第三次实验后所得溶液中溶质是_____(写化学式)
(2)混合物中氧化铜的质量分数为_____
(3)实验中所用稀硫酸溶质的质量分数是多少?_____
【答案】4g CuSO4、H2SO4 62.5% 24.5%
【解析】
氧化铜和稀硫酸反应生成硫酸铜和水。
(1) 加入10g稀硫酸,有![]() 氧化铜参加反应,则再加入10g稀硫酸时又会有2g氧化铜参加反应,故
氧化铜参加反应,则再加入10g稀硫酸时又会有2g氧化铜参加反应,故![]() ,氧化铜和稀硫酸反应生成硫酸铜和水,稀硫酸过量,故第三次实验后所得溶液中溶质是硫酸铜和稀硫酸,化学式为CuSO4、H2SO4。
,氧化铜和稀硫酸反应生成硫酸铜和水,稀硫酸过量,故第三次实验后所得溶液中溶质是硫酸铜和稀硫酸,化学式为CuSO4、H2SO4。
(2) 最终剩余3g固体是铜,则氧化铜的质量是![]() ,故混合物中氧化铜的质量分数为
,故混合物中氧化铜的质量分数为![]() 。
。
(3) 加入10g稀硫酸溶液,有2g氧化铜参加反应
设:与2g氧化铜反应的硫酸的质量为x
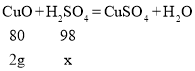
![]()
![]()
实验中所用稀硫酸溶质的质量分数是![]() 。
。
答:实验中所用稀硫酸溶质的质量分数是24.5%。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】某校课外小组同学用含有泥沙和氯化钠杂质的碳酸钠样品进行了如下实验:向一只60 g的烧杯中加入35 g样品,然后分5次加入盐酸,每次加入盐酸40 g(不考虑水、氯化氢逸出),每次反应完全后,称量烧杯和烧杯内物质的总质量。记录实验数据如下:
加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
烧杯和烧杯内物质的总质量/g | 132.8 | 170.6 | 208.4 | 246.2 | 286.2 |
已知:(1)第5次加酸后,烧杯底部剩余不溶固体2.1g。泥沙成分为SiO2,它不溶于水,也不与盐酸发生反应。
(2)![]()
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为_________。
(2)反应结束时得到氯化钠的质量_______ 。
(3)碳酸钠样品中钠元素与氯元素的质量比_________。