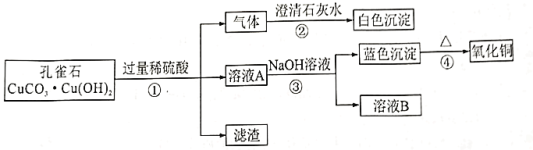
题目内容
【题目】某兴趣小组在实验室中对金属Na与CO2的反应进行了探究。回答下列问题:
(1)CO2气体的制备
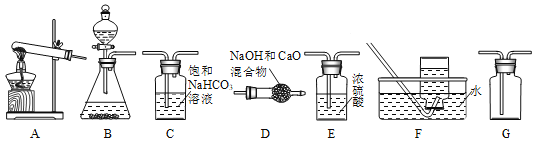
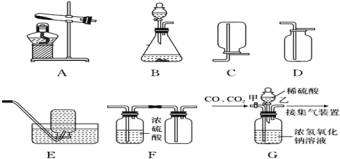
①CO2气体的发生装置可以选择上图中的___(填标号),反应的化学方程式为__。
②欲收集一瓶纯净干燥的CO2气体,选择上图中的装置,其连接顺序为:发生装置→_____→______→_____(填标号)。
(2)金属Na与CO2的反应
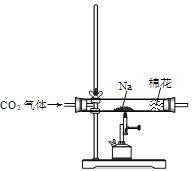
步骤 | 现象 | 结论 |
I.按以上装置进行实验,充分反应后,将硬质玻璃管中的固体产物移至烧杯,加入①____(填试剂名称) | 固体部分溶解,产生大量气泡 | |
II.将步骤I中产生的气体通入澄清石灰水 | ②____ | 该气体为CO2 |
III.对步骤I中剩余的固液混合物进行过滤、洗涤、干燥 | 得到黑色固体粉末 |
③结合上述实验步骤I、II可得,固体产物中存在Na2CO3;经检测,步骤III中得到的黑色固体为单质碳,则金属Na与CO2气体发生反应的化学方程式为______。
【答案】B CaCO3+2HCl=CaCl2+H2O+CO2↑ C E G 稀盐酸 澄清石灰水变浑浊 4Na+3CO2![]() 2Na2CO3+C
2Na2CO3+C
【解析】
(1)实验室制取二氧化碳用的是石灰石跟稀盐酸,固液混合不加热的方法,反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑;由图象和题意可知,B装置符合;题目中说要收集纯净干燥的二氧化碳,首先我们要考虑的是纯净,因为稀盐酸是氯化氢气体的水溶液,氯化氢气体容易挥发,所以二氧化碳气体中可能混有氯化氢气体,除去二氧化碳气体中的氯化氢气体,应选择饱和的碳酸氢钠溶液,又因为我们要得到干燥的二氧化碳,所以要选择干燥剂,干燥二氧化碳气体要选择浓硫酸干燥,不能选用氢氧化钠与氧化钙的固体混合物,因为二氧化碳会和氢氧化钠反应,会减少二氧化碳的含量,最后干燥的二氧化碳密度比空气大,用向上排空气法收集;因为我要的是纯净干燥的二氧化碳,所以要先除杂在干燥,防止干燥后在进入水蒸气;欲收集一瓶纯净干燥的CO2气体,选择上图中的装置,其连接顺序为:发生装置→C→E→G;
(2)由题意和表格信息可知,固体部分溶解,产生大量二氧化碳气体,分析可知应该是酸与碳酸盐反应,所以酸溶液可以选择稀盐酸溶液;将二氧化碳通入澄清石灰水的现象是澄清石灰水变浑浊,根据分析和实验证实金属钠与二氧化碳反应生成碳酸钠和单质碳,由于图象上用的时酒精喷灯,所以反应条件应该是高温,故化学方程式为:4Na+3CO2![]() 2Na2CO3+C。
2Na2CO3+C。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】硫酸是一种重要的化工原料,也是实验室中常用的化学试剂。某兴趣小组对硫酸的性质、制取、用途等方面的探究,请你共同参与并回答有关问题。
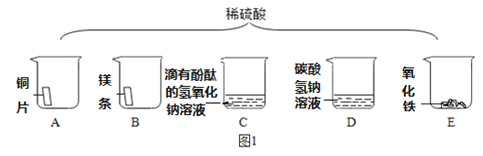
(探究一)硫酸的性质
(1)如图1将足量的稀硫酸分别加入A~E五只烧杯中。无现象的是_____________(填序号)。
(2)烧杯C中的现象是红色褪去,反应后溶液中溶质是什么呢?(无色酚酞不考虑)
(猜想)猜想一:只有Na2SO4 ; 猜想二:有_________________;
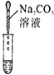
(3)为了验证猜想,小组同学取烧杯中的溶液,并选用老师提供的pH试纸、BaC12溶液、Na2CO3溶液,分别进行如下三组探究实验。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
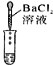
实验操作 |
|
|
|
实验现象 | 试纸变色,比照比色卡,pH<7 | ____________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,小组同学一致确定猜想二是正确的。
(评价反思)老师指出上述三个实验探究中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
①实验操作中明显的一处错误是_________________________________________;
②实验探究方案中也有一个是不合理的,不合理的原因是____________________________。
(探究二)硫酸的工业制法
工业上以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程如图所示,其中沸腾炉内发生的主
要反应是: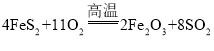

(1)接触室中发生的化学方程式为_________________________________________。
(2)接触室中的SO2平衡转化率与温度及压强的关系如下图所示,催化剂活性与温度的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃(对应图中A点),而没有选择SO2转化率更高的C点对应的反应条件,其原因是___________________________________。
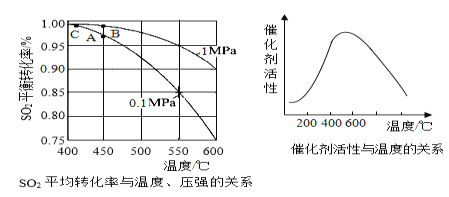
(探究三)探究某黄铁矿中FeS2的含量。
(查阅资料)![]()
(实验探究)Ⅰ称取1.60g黄铁矿样品放入如图所示装置(夹持装置省略)的石英管中,从a处不断地缓缓通入空气、高温灼烧石英管中的黄铁矿样品至完全反应(同工业上沸腾炉内的反应)。

Ⅱ反应结束后,将乙瓶中的溶液进行如下图处理。

(问题讨论)I中装置甲瓶内盛放的试剂是氢氧化钠溶液,其作用是_____________________。
(含量测定)计算该黄铁矿中FeS2的质量分数为_______________。(写出计算过程)