题目内容
【题目】某学习小组探究氢氧化钙溶液的化学性质,并作了延伸探究。
探究一:甲同学设计了如下实验方案,请你帮助完成实验报告。
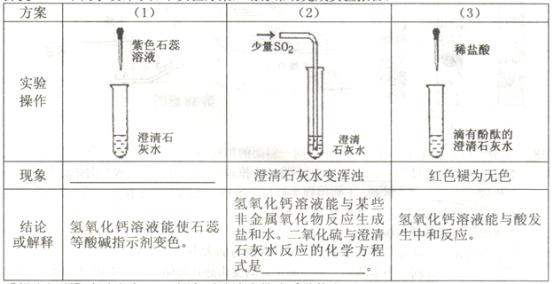
【提出问题】实验方案(3)褪色后溶液中的溶质是什么?
【查阅资料】氯化钙溶液呈中性。
【作出猜想】乙同学从反应情况分析,溶液中除含少量酚酞外,溶质可能有以下三种情况:
①氯化钙 ②氯化钙和氯化氢 ③氯化钙和氢氧化钙
【分析讨论】丙同学从实验现象分析得出:猜想③肯定不合理,其理由是 。
探究二:丁同学为进一步验证乙同学的猜想,设计实验如下:将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴加边振荡。实验后得出产生沉淀质量与碳酸钠溶液体积之间的关系,如图所示。写出实验过程中的现象 。
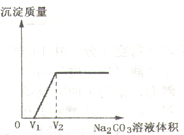
【得出结论】乙同学的猜想中, (填序号)合理。
【反思讨论】学习小组结合图像,分析了丁同学实验过程中烧杯内溶液的变化。下列说法正确的是 (填序号)
A.溶液质量逐渐增大
B.氯化钠质量逐渐增大,V2后不变
C.氯化钙的质量先增大后减小
D.溶液的pH一直增大
【答案】探究一:现象:溶液变为红色。化学方程式为:Ca(OH)2+SO2===H2O+CaSO3↓【分析讨论】因为氢氧化钙的存在溶液的颜色就会是红色,而不是无色。探究二:开始会有气泡产生,等气泡停止后就会产生白色的沉淀【得出结论】②【反思讨论】AB
【解析】
试题分析:根据酸碱同指示剂的反应看澄清的石灰水能够使得石蕊变红,二氧化碳能够和澄清的石灰水反应产生沉淀,而二氧化硫和二氧化碳的反应一样,因此根据二氧化碳和石灰水的反应可以推断该反应为:Ca(OH)2+SO2===H2O+CaSO3↓;从实验现象分析得出:猜想③肯定不合理,其理由是因为氢氧化钙的存在溶液的颜色就会是红色,而不是无色。将实验方案(3)褪色后溶液倒入烧杯中,向其中逐滴滴加稀碳酸钠溶液至过量,边滴加边振荡。实验后得出产生沉淀质量与碳酸钠溶液体积之间的关系看:开始没有沉淀,说明其中含有盐酸,因此现象是开始会有气泡产生,等气泡停止后就会产生白色的沉淀,因此猜想②符合,分析丁同学实验过程中烧杯内溶液的变化中溶液质量逐渐增大;氯化钠质量逐渐增大,V2后反应结束因此氯化钠的质量不变。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】列出去杂质的方法中正确的是
选项 | 物质 | 杂质 | 除杂质的方法 |
A | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
B | K2CO3溶液 | KCl | 加适量稀盐酸 |
C | CaO | CaCO3 | 加水,过滤 |
D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |