题目内容
【题目】用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,他们设计了下列两种实验方案进行试验.
(1)[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
①样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液.
②分析滴加的CaCl2溶液要过量的原因:;
③将反应后的混合物进行过滤,把获得的沉淀物洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为 .
(2)[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).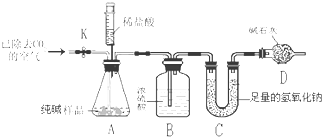
①打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,其目的是 , 然后再接上装置C和D.
②关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应).
③待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿,若省略此步骤,将会使测定结果(选填“偏大”或“偏小”).若没有装置D,将会使测定结果(选填“偏大”或“偏小”).
【答案】
(1)使样品中的碳酸钠完全反应,若不洗涤沉淀物,那么沉淀物的质量为增大,利用沉淀物质量计算Na2CO3的质量就会增大
(2)为了排尽装置A和B中含有的CO2,偏小,偏大
【解析】(1)②滴加的CaCl2溶液要过量的原因与碳酸钠充分反应;③不洗涤碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大从而导致样品中Na2CO3的质量分数偏大;
(2)①空气中含有二氧化碳,所以打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D;③待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿,这样做是为了将生成的二氧化碳完全吸收,否则会导致结果偏小;装置D的作用是防止空气中的二氧化碳和水蒸气进入装置C,所以若没有装置D,将会使测定结果偏大.
所以答案是:(1)使样品中的碳酸钠完全反应;若不洗涤沉淀物,那么沉淀物的质量为增大,利用沉淀物质量计算Na2CO3的质量就会增大;(2)为了排尽装置A和B中含有的CO2;偏小;偏大.