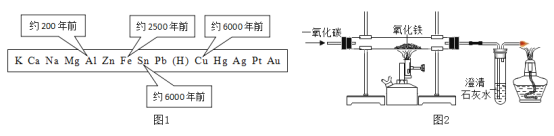
题目内容
【题目】小张同学为了测定鸡蛋壳中碳酸钙的质量分数,进行了如下实验探究.
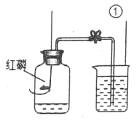
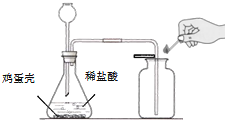
(实验过程)小张同学组装了如图装置.将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应).测得相关数据如下所示:鸡蛋壳(12.5g)+稀盐酸(40.5g)![]() 剩余的混合物(48.6g)
剩余的混合物(48.6g)
(数据处理)
(1)根据质量守恒定律,反应生成二氧化碳的质量为______g.
(2)请用化学方程式计算蛋壳中碳酸钙的质量分数是____?(写出计算过程)
【答案】4.4 设蛋壳中碳酸钙的质量为x,则有:

由![]() 解得x=10g
解得x=10g
蛋壳中碳酸钙的质量分数为![]()
答:蛋壳中碳酸钙的质量分数为80%。
【解析】
(1)由题意,根据质量守恒定律,反应生成二氧化碳的质量为12.5g+40.5g-48.6g =4.4g;
(2)设蛋壳中碳酸钙的质量为x,则有:

由![]() 解得x=10g
解得x=10g
蛋壳中碳酸钙的质量分数为![]()
答:蛋壳中碳酸钙的质量分数为80%。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
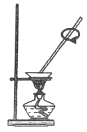
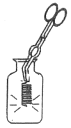
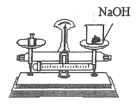
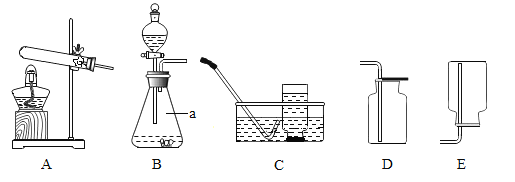
【题目】实验是科学探究的重要途径,请根据图示回答相关问题。
|
|
|
|
A测定空气中氧气含量 | B蒸发 | C铁丝在氧气中燃烧 | D称量NaOH固体 |
(1)A图实验的结论是___________________________________。
(2)B图中玻璃棒搅拌的目的是______________________________。
(3)C图中的实验操作会导致的后果是___________________________。
(4)D图中出现的错误是___________________________。