题目内容
结合下列实验装置图回答问题:
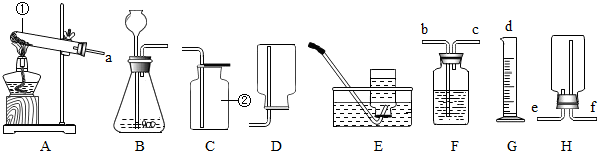
(1)写出仪器的名称①
(2)实验室用高锰酸钾制取氧气时,发生反应的化学方程式为
反应的类型为
(3)实验室选用装置B作为制取氧气的发生装置,发生反应的化学方程式为
①生成物只有氧气 ②不需加热 ③需加热
(4)若装置B中反应很剧烈,据此提出实验安全注意事项是
①控制液体的加入速度 ②用体积较小的锥形瓶 ③加热反应物
(5)1909年化学家哈伯在实验室首次将氮气和氢气在一定条件下合成了氨气(NH3).常温下,氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水,氨和氧气在铂催化剂和一定温度下反应产生一氧化氮和水.
①从以上信息中你能总结出氨气的物理性质是
②实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,发生装置应选用
(6)F装置可以收集和储备氧气,若用水将装置中的氧气排出,水应从
(7)利用药品氯酸钾和装置A、F(装满水)、G可以制取氧气并测量其体积,则接口的顺序为(填abcd):
a→

(1)写出仪器的名称①
试管
试管
②集气瓶
集气瓶
(2)实验室用高锰酸钾制取氧气时,发生反应的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,
| ||
反应的类型为
分解
分解
反应.收集氧气可选用E装置,理由是氧气不易溶于水
氧气不易溶于水
,若选择C装置收集氧气,则验满的方法是将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了
.用高锰酸钾制氧气的实验中,如果发现试管破裂,原因可能是没有预热
没有预热
.(任写一种)(3)实验室选用装置B作为制取氧气的发生装置,发生反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集O2,过一段时间后,用带火星的木条身入瓶口、瓶中、瓶底,都没见木条复燃,其原因可能是
| ||
装置不严密
装置不严密
.若实验时用此法代替KMnO4加热制取O2,优点是②
②
(填编号).①生成物只有氧气 ②不需加热 ③需加热
(4)若装置B中反应很剧烈,据此提出实验安全注意事项是
①
①
(填编号)①控制液体的加入速度 ②用体积较小的锥形瓶 ③加热反应物
(5)1909年化学家哈伯在实验室首次将氮气和氢气在一定条件下合成了氨气(NH3).常温下,氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水,氨和氧气在铂催化剂和一定温度下反应产生一氧化氮和水.
①从以上信息中你能总结出氨气的物理性质是
氨气是一种无色有刺激性气味的气体,或密度小于空气,或极易溶解于水
氨气是一种无色有刺激性气味的气体,或密度小于空气,或极易溶解于水
(写出一条即可)②实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,发生装置应选用
A
A
装置,若使用装置H收集氨气,则气体应从f
f
(填e或f)通入.同学们一致认为,选择C装置收集氨气不合理,理由是氨气密度小于空气
氨气密度小于空气
(6)F装置可以收集和储备氧气,若用水将装置中的氧气排出,水应从
b
b
端通入.(7)利用药品氯酸钾和装置A、F(装满水)、G可以制取氧气并测量其体积,则接口的顺序为(填abcd):
a→
b
b
→c
c
→d
d
.分析:试管常用的反应容器,集气瓶是收集气体的仪器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.用高锰酸钾制氧气的实验中,如果发现试管破裂,原因可能是:没有预热、用焰心加热、试管口略向上倾斜等.氨气的物理性质是:常温下,氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水;实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,因此需要加热;若使用装置H收集氨气,则气体应从长管进入,因为氨气的密度比空气小,因此氨气不能用向上排空气法收集;F装置可以收集和储备氧气,若用水将装置中的氧气排出,水应从长管通入.利用药品氯酸钾和装置A、F(装满水)、G可以制取氧气并测量其体积,则接口的顺序为:abcd.
解答:解:(1)试管常用的反应容器,集气瓶是收集气体的仪器,故答案为:试管;集气瓶;
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;用高锰酸钾制氧气的实验中,如果发现试管破裂,原因可能是:没有预热、用焰心加热、试管口略向上倾斜等;故答案为:2KMnO4
K2MnO4+MnO2+O2↑;分解;氧气不易溶于水;将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;没有预热;
(3)如果用双氧水和二氧化锰制氧气就不需要加热,比用KMnO4加热制取O2,优点是:不需加热,节约能源;如果装置不严密,就收集不到氧气;故答案为:2H2O2
2H2O+O2↑;装置不严密;②;
(4)若装置B中反应很剧烈,防止发生安全事故的措施是:控制液体的加入速度;故答案为:①
(5)氨气的物理性质是:常温下,氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水;实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,因此需要加热;若使用装置H收集氨气,则气体应从长管进入,因为氨气的密度比空气小,因此氨气不能用向上排空气法收集;故答案为:①氨气是一种无色有刺激性气味的气体,或密度小于空气,或极易溶解于水;②A;f;氨气密度小于空气;
(6)F装置可以收集和储备氧气,若用水将装置中的氧气排出,水应从长管通入;故答案为:b
(7)利用药品氯酸钾和装置A、F(装满水)、G可以制取氧气并测量其体积,则接口的顺序为:abcd;故答案为:b c d
(2)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;用高锰酸钾制氧气的实验中,如果发现试管破裂,原因可能是:没有预热、用焰心加热、试管口略向上倾斜等;故答案为:2KMnO4
| ||
(3)如果用双氧水和二氧化锰制氧气就不需要加热,比用KMnO4加热制取O2,优点是:不需加热,节约能源;如果装置不严密,就收集不到氧气;故答案为:2H2O2
| ||
(4)若装置B中反应很剧烈,防止发生安全事故的措施是:控制液体的加入速度;故答案为:①
(5)氨气的物理性质是:常温下,氨气是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水;实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,因此需要加热;若使用装置H收集氨气,则气体应从长管进入,因为氨气的密度比空气小,因此氨气不能用向上排空气法收集;故答案为:①氨气是一种无色有刺激性气味的气体,或密度小于空气,或极易溶解于水;②A;f;氨气密度小于空气;
(6)F装置可以收集和储备氧气,若用水将装置中的氧气排出,水应从长管通入;故答案为:b
(7)利用药品氯酸钾和装置A、F(装满水)、G可以制取氧气并测量其体积,则接口的顺序为:abcd;故答案为:b c d
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和气体的验满等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 “嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.
“嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题. D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子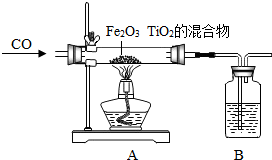

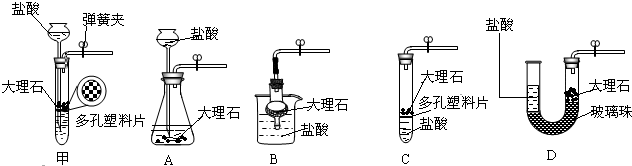

 (2)结合下列实验装置图回答问题:
(2)结合下列实验装置图回答问题: E.为了防止冷凝水回流,给试管中固体加热时,试管口略向下倾斜
E.为了防止冷凝水回流,给试管中固体加热时,试管口略向下倾斜